Cáncer de endometrio-útero
Índice de navegación
AUTORA: Dra. Luisa Sánchez Lorenzo
El útero es un órgano hueco muscular en forma de pera invertida. Está situado en la pelvis femenina delante del recto, por detrás de la vejiga y en contacto con la vagina. En su parte superior a cada lado entran las trompas de Falopio.

Se divide en dos porciones:
- Cuerpo uterino: los constituyen los dos tercios superiores y tiene dos porciones el fondo (porción redondeada por encima de la entrada de las trompas de Falopio) y el itsmo (región inmediatamente por encima del cuello uterino).
- Cuello uterino o cérvix que protuye en la parte superior de la vagina.
La pared del cuerpo uterino consta de tres capas:
- Perimetrio: túnica serosa externa.
- Miometrio: túnica muscular media, capa gruesa de tejido muscular liso que se distiende durante el embarazo. Aquí están localizados los principales vasos y nervios del útero.
- Endometrio: túnica mucosa interna que se adhiere al miometrio. Este revestimiento se renueva cada mes tras la menstruación.
Existen lesiones uterinas benignas que deberán ser vigiladas por sus posibles complicaciones. Los miomas son tumores benignos que tienen su origen en el pared muscular del útero. La endometriosis es la presencia de tejido endometrial fuera del útero y puede suponer un mayor riesgo para el desarrollo de otros tumores. Los tumores del útero se originan en su mayoría en el endometrio debido a los cambios en estas células.
Datos epidemiológicos
El cáncer de útero a nivel global es la 6ª neoplasia más frecuente en mujeres y la 2º neoplasia ginecológica tras el cáncer de cérvix. Se calcula que en 2020 se diagnosticaron unos 417.000 nuevos casos (8.7 casos/100.000 mujeres) y se registraron casi 97.000 muertes (1.8/100.000 mujeres). En países desarrollados es el cáncer ginecológico más frecuente. La tasas de incidencia en estos países representan 15.9 casos/100.000 mujeres con una mortalidad de 2.4/100.000 mujeres.
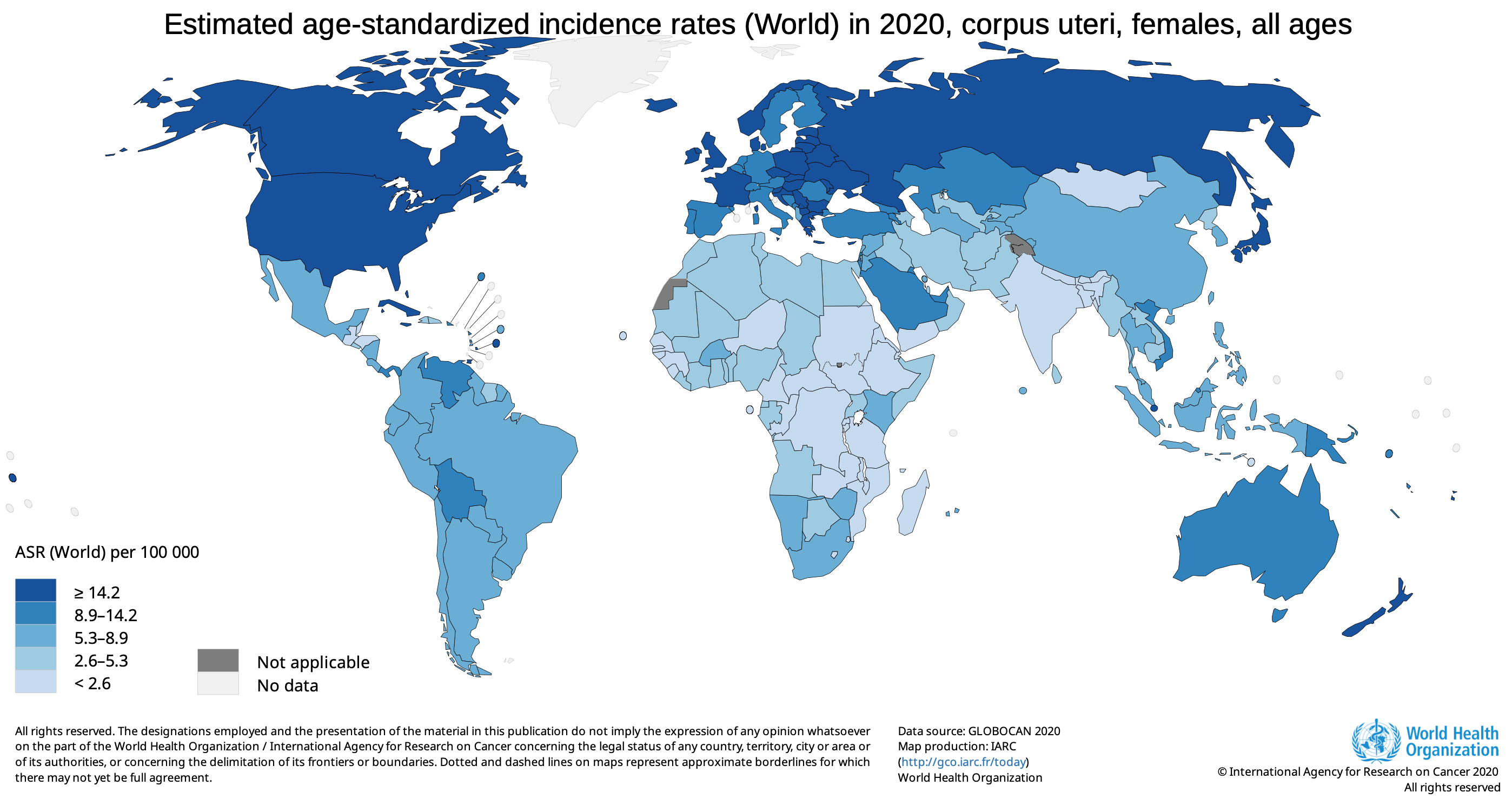
En España el cáncer de endometrio es la 4ª neoplasia más frecuente en mujeres con 6597 nuevos casos en 2020, aproximadamente con una incidencia de 13.1 casos/100.000 mujeres /año y una mortalidad de 2.2 casos/ 100.000 mujeres/ año..
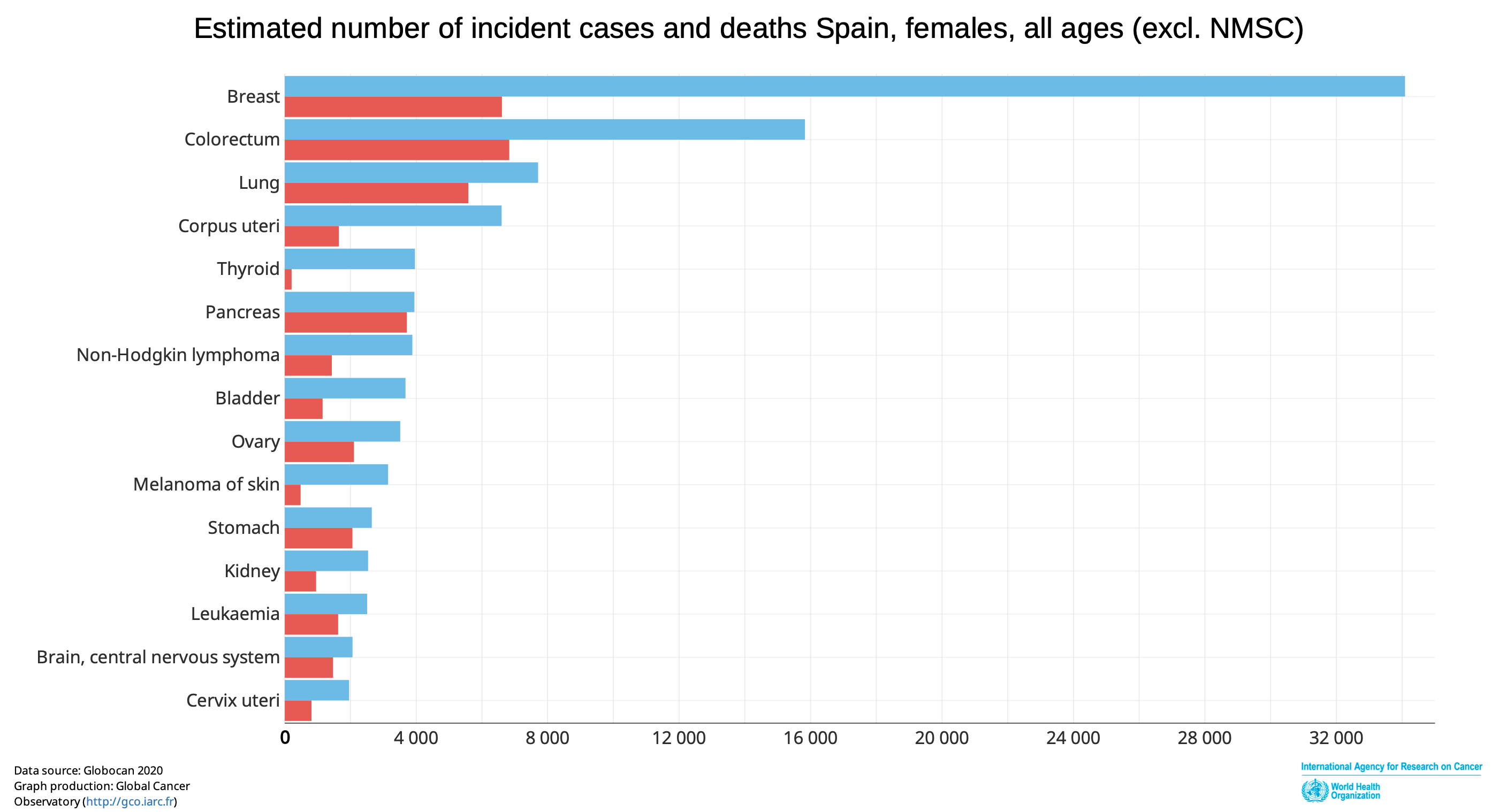
La mediana de edad al diagnóstico es de 63 años, pero más del 90% de los casos se diagnostican en mujeres > 50 años. Un 4% de las pacientes son diagnosticadas antes de los 40 años.
Un 75-80% de los casos son diagnosticados en estadio I con una tasa de supervivencia a 5 años de un 95%. Desafortunadamente la tasa de supervivencia a 5 años es más baja cuando existe diseminación regional (72%) o a distancia (20%).
Factores de riesgo
La mayoría de los casos no se pueden prevenir, pero la reducción de factores de riesgo puede disminuir la probabilidad de desarrollar la enfermedad.
Es muy importante dar a conocer a todas las mujeres los factores de riesgo y síntomas del cáncer de endometrio.
|
FACTORES DE RIESGO |
|
Exceso de exposición a estrógenos:
|
|
Edad, media de edad al diagnóstico 62 años. |
|
Historia familiar:
|
|
Dieta: resultados contradictorios sobre el aumento de riesgo asociado al consumo de azúcar, alcohol o grasas y el efecto protector del café o vegetales. |
|
Nuliparidad o infertilidad. Los datos publicados respecto al riesgo que pueden suponer los tratamientos de inducción ovulatoria son inconsistentes. |
|
Menarquia precoz y menopausia tardía (>55 años). |
|
Etnia caucásica parece tener mayor riesgo de desarrollar cáncer de endometrio. Otras etnias son diagnosticadas con estadios más avanzados de la enfermedad. |
|
Región geográfica: las mujeres que viven en países desarrollados tiene mayor riesgo de desarrollar un cáncer de endometrio. Esto parece estar relacionado con la expectativa de vida, ya que este tipo de tumor se desarrolla más frecuentemente con >50 años. |
|
Radioterapia pélvica previa por otra neoplasia. |
Cáncer de útero hereditario
Se considera que de la totalidad de cánceres de endometrio diagnosticados actualmente sólo un 2-5% son hereditarios, si la paciente fue diagnosticada antes de los 50 años esta cifra asciende hasta el 10%.El riesgo poblacional de una mujer de desarrollar cáncer de endometrio es aproximadamente de un 2%, pero cuando está en relación con algún síndrome heredo-familiar su riesgo se sitúa entre un 3-70%.
Los síndromes hereditarios más frecuentemente relacionados con el cáncer de endometrio son el Sd de Lynch y el Sd de Cowden, este último más infrecuente. En los últimos años también se ha relacionado el síndrome de cáncer mama y ovario hereditario (BRCA1/2) con el desarrollo de cáncer de endometrio especialmente en BRCA1 mientras que la relación con BRCA2 es todavía más dudosa. Otros síndromes heredo-familiares posiblemente relacionados son el Sd de Peutz-Jeghers y Sd de Li-Fraumeni.
Sd Lynch |
|
|
|
|
|
Anatomía patológica y biología molecular
Clásicamente la clasificación de los tumores es histológica pero según se van adquiriendo nuevos conocimientos a nivel de biología molecular podemos incorporarlos como información adicional que nos permitirá una mejor identificación.
Clasificación histológica:
Clasificación molecular:
Permite estratificar los tumores por el número de mutaciones pudiendo predecir la sensibilidad a la inmunoterapia (antiPD-L1) y aportando también información pronóstica, que ya ha pasado a formar parte de las nuevas guías ESMO/ESGO/ESP para el manejo terapéutico de las pacientes.
En la práctica clínica se están usando marcadores inmunohistoquímicas (p53, MLH1, MSH2, PMS2, MSH6) y un test molecular (mutaciones en POLE) con intención de hacer una aproximación.
POLE mutado
|
- Número de mutaciones muy elevado (TMB >100mut/Mb). - Morfología endometrioide. - Alto infiltrado inmunitario (linfocitos CD8+ y TILs) - Pronóstico excelente. |
MMRd
|
- Número de mutaciones alta (TMB >10mut/Mb). - En su mayoría endometrioides. - Mutación en algunos de los genes MMR (MLH1, MSH2, MSH6, PMS2) . - Pronóstico intermedio. |
NSMP
|
- Tumores con escasa variación del número de copias. - Carga mutacional baja (TMB-bajo). - Endometrioides de bajo grado o histologías mixta. - Pronóstico intermedio/malo. |
p53 abn
|
- Tumores con elevada variación del número de copias. - Carga mutacional muy baja (TMB-bajo). - Histologías: serosa, células claras, carcinosarcoma y algún endometrioide. - Mal pronóstico. |
Signos y síntomas
- Sangrado genital anómalo: síntoma cardinal (hasta un 75-90% de los casos)
1. En < 45años valorar si tienen sangrado persistente y tiene algún factor de riesgo o han estado sometidas a tratamiento prolongado con estrógenos sin oposición de progestágenos.
2. En perimenopausia (45-55 años) estudiar a las pacientes con pérdidas intermenstruales, menstruación frecuente (<21 días) y sobre todo si esta es abundante o prolongada (>7 días).
3. En postmenopausia se debe estudiar cualquier sangrado ginecológico, en un 10-20% de los casos subyace un cáncer uterino. - Secreción vaginal purulenta.
- Síntomas en edad avanzada: dolor o distensión abdominal, alteración del tránsito gastrointestinal, clínica respiratoria y sd constitucional (astenia, anorexia y pérdida significativa de peso).
- Hallazgos sospechosos en citología vaginal en pacientes asintomáticas: presencia de adenocarcinoma, células glandulares atípicas y células endometriales en >40-45 años.
- Relaciones sexuales dolorosas y/o dolor en la parte baja del abdomen.
Diagnóstico
Ante alguno de los signos y síntomas de sospecha la paciente debe remitirse a consulta de ginecología para valoración.
1. Anamnesis dirigida: recopilación de los factores de riesgo personales y familiares de la paciente.
2. Exploración ginecológica: inspección con espéculo y colposcopia, tacto vagino-abdominal que permitirá definir el tamaño del útero y tacto recto-vaginal para hacer una aproximación del tamaño del útero o si se sospecha infiltración de tabique recto vaginal y parametrios. No se debe olvidar realizar palpación de los territorios ganglionares.
3. Ecografía transvaginal: introducción a través de la vagina de una sonda ecográfica que permite medir el grosor del endometrio, se suele establecer el punto de corte del grosor en 3mm, que puede ser diferente en función de si la paciente es pre y postmenopáusica. Si el grosor es superior o existe persistencia del sangrado ginecológico se proseguirá con pruebas diagnósticas.
4. Histeroscopia: es un examen visual del cuello uterino y del interior del útero con un fino tubo flexible. Esta prueba puede tener fines diagnósticos y terapéuticos. La visión directa del interior del útero nos permite tomar un biopsia de cualquier zona de sospecha, extracción de pólipos, fibromas o cauterización de zonas de sangrado. Se puede realizar con anestesia local o sin anestesia y es un procedimiento ambulatorio.
5. Biopsia endometrial por aspiración: técnica mínimamente invasiva y ambulatoria que permite la toma de biopsias a ciegas de las caras del útero y ángulos uterinos. Alta sensibilidad de especificidad en mujeres pre y postmenopáusicas.
6. Biopsia: toma de un pequeño fragmento del endometrio para corroborar el diagnóstico de sospecha.

En caso de confirmarse el diagnóstico de cáncer de endometrio se solicitarán pruebas complementarias:
7. Marcadores tumorales: e solicita habitualmente CA125, utilidad variable según el tipo de histología.
8. Rectoscopia y cistoscopia: permiten visualización directa del recto y la vejiga respectivamente y sólo se valorará ante elevada sospecha de infiltración tumoral.
9. Pruebas de imagen:
a. Resonancia magnética de pelvis (RM): prueba de elección para el estadiaje preoperatorio ya que es la que mejor valora la extensión locorregional del tumor siendo de especial interés el grosor de la línea endometrial, la existencia de masas en el interior del miometrio, el grado de infiltración del miometrio, la afectación o no del cérvix y la valoración de adenopatías aumentadas de tamaño.
b. Tomografía computarizada (TC): muy útil para la valoración de las adenopatías y la presencia de metástasis a distancia.
c. PET-TC: mayor sensibilidad que TC o RM para la detección de metástasis ganglionares. Actualmente, si bien está ampliamente aceptada como parte del estudio de extensión inicial su principal papel es en la detección de las recidivas o de cara al tratamiento de una recidiva local.
Estadificación
El estadiaje de un tumor nos permite poder definir con claridad su tamaño, localización, extensión local y a distancia (metástasis). La correcta estadificación de un tumor nos permite el diseño de la estrategia terapéutica. Los dos sistemas de clasificación utilizados son el sistema TNM y el FIGO estando este segundo más extendido, pero existiendo correlación entre ambos. La última actualización del sistema FIGO de endometrio es de 2023, siendo el que utilizamos en la actualidad para clasificar a los carcinomas uterinos y carcinosarcomas. Respecto a la clasificación anterior de 2009 ha incorporado la clasificación molecular y la invasión linfovascular (ILV). Los sarcomas de origen uterino (leiomiosarcomas y sarcomas del estroma endometrial) seguirán una clasificación diferente de TNM y FIGO.
|
Estadificación de cáncer de útero FIGO 2023 |
|
|
Estadio I |
El tumor confinado al cuerpo uterino y ovario. |
|
IA |
Enfermedad limitada al endometrio O tipo histológico no agresivo*, con invasión miometrial de <50% con ILV ausente o focal, O enfermedad de buen pronóstico (POLE ultramutado) |
|
IA1 |
Tipo histológico no agresivo limitado a un pólipo endometrial o confinado al endometrio |
|
IA2 |
Tipos histológicos no agresivos con invasión miometrial <50% con ILV ausente o focal |
|
IA3 |
Carcinomas endometrioides de bajo grado limitados al útero y ovario |
|
IB |
Tipos histológicos no agresivos con invasión miometrial ≥50%, y con ILV ausente o focal |
|
IC |
Tipos histológicos agresivos limitados a un pólipo o confinados al endometrio |
|
Estadio II |
El tumor invade el estroma cervical con extensión extrauterina O con ILV sustancial O tipos histológicos agresivos con invasión miometrial |
|
IIA |
Invasión del estroma cervical (aclarar que la afectación glandular cervical se considera estadio I y no II) de tipos histológicos no agresivos. |
|
IIB |
Invasión ILV sustancial de tipos histológicos no agresivos. |
|
IIC |
Tipos histológicos agresivos con invasión miometrial |
|
Estadio III |
Extensión loco-regional del tumor (la citología positiva se debe informar de forma separada sin que modifique el estadio) de cualquier subtipo histológico. |
|
IIIA |
Tumor con invasión de la serosa uterina, los anexos o ambos por extensión directa o metástasis. |
|
IIIA1 |
Afectación ovárica o de la trompa de Falopio (excepto si cumple los criterios de estadio IA3) |
|
IIIA2 |
Afectación de la subserosa uterina o propagación a través de la serosa uterina. |
|
IIIB |
Afectación vaginal y/o parametrial o al peritoneo pélvico |
|
IIIB1 |
Metástasis o afectación vaginal, y/o parametrial |
|
IIIB2 |
Metástasis en el peritoneo pélvico |
|
IIIC |
Afectación metastásica ganglionar pélvica y/o para-aórtica. |
|
IIIC1 |
Ganglios pélvicos positivos |
|
IIIC1i |
Afectación micrometastática |
|
IIIC1ii |
Afectación macrometastática |
|
IIIC2 |
Ganglios para-aórticos positivos con o sin ganglios pélvicos positivos. |
|
IIIC2i |
Afectación micrometastática |
|
IIIC2ii |
Afectación macrometastática |
|
Estadio IV |
El tumor invade la mucosa vesical y/o rectal, y/o metástasis a distancia. |
|
IVA |
Invasión de la mucosa vesical, mucosa rectal o ambas |
|
IVB |
Metástasis abdominales peritonales/carcinomatosis peritoneal más allá de la pelvis. |
|
IVC |
Metástasis a distancia, incluyendo metástasis en adenopatías inguinales, pulmón, hígado, hueso, etc. |
Factores pronósticos
- El estadio oncológico es uno de los factores pronósticos más importantes. Aquí quedan incluidos invasión miometrial, afectación cervical y afectación ganglionar.
- El grado histológico es el otro factor pronóstico más importante. Se basa en el grado de diferenciación del adenocarcinoma (porcentaje de crecimiento sólido del tumor), cuanto más bajo sea el grado mejor pronóstico:
- Grado 1: ≤5% de crecimiento sólido no escamoso o no morular (bien diferenciado).
- Grado 2: 6% a 50% de crecimiento sólido no escamoso o no morular (moderadamente diferenciado).
- Grado 3: 50% de crecimiento sólido no escamoso o no morular (pobremente diferenciado o desdiferenciado). - La clasificación molecular (integrada en la guías ESMO/ESGO/ESP y en la nueva clasificación de la FIGO pero no en las previas)
- Subtipo histológico.
- Invasión linfovascular.
- Clínicos: edad y raza.
Tratamiento
Tratamiento quirúrgico inicial del cáncer de endometrio:
La cirugía es el eje vertebrador del tratamiento. En aquellas pacientes con cáncer de endometrio subtipo endometrioide IAG1 y sin deseo genésicos cumplidos debe ser valoradas en comité de cara a plantear posponer el tratamiento quirúrgico definitivo.
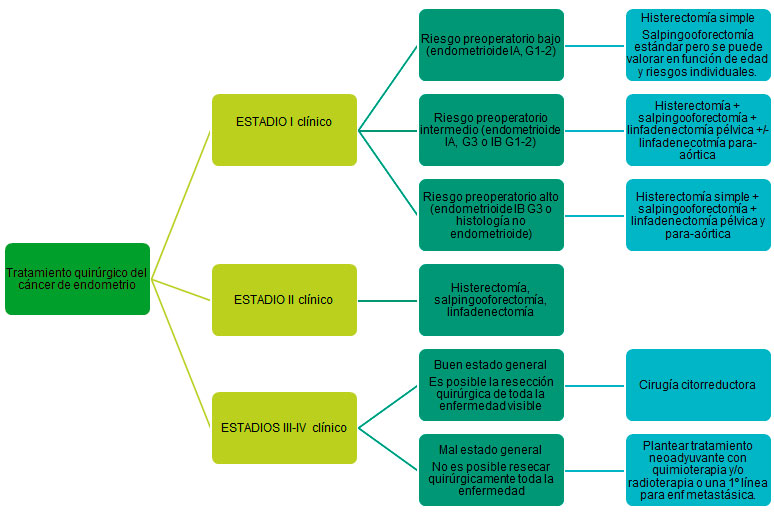
Tratamiento adyuvante:
La idoneidad del tratamiento posterior al abordaje quirúrgico viene definido en base a su riesgo de recaída. Estos grupos se han realizado en base a los factores pronósticos clínicos y moleculares
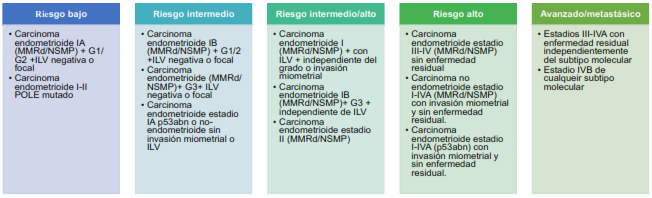

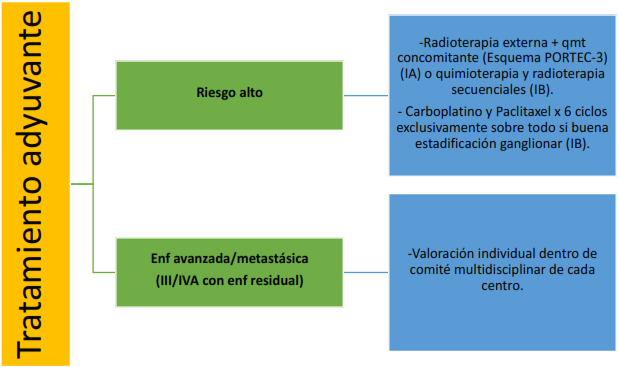
Tratamiento de la recaída local :
En pacientes diagnosticadas de una recaída local (entre un 25-40%) antes de proponer cualquier tratamiento se debe tener en consideración la biología del tumor, el intervalo libre de enfermedad, el número de lesiones y localización, los tratamientos previos, la resecabilidad y el estado general de la pacientes.

Tratamiento de la recaída sistémica :
En pacientes con una recaída sistémica el tratamiento dependerá de la histología y la biología molecular. En aquellas pacientes con tumores endometrioides de bajo grado y con receptores hormonales positivos se planteará tratamiento con hormonoterapia. En tumores de alto grado o histologías no endometrioides el tratamiento estándar consistirá en un esquema de tratamiento basado en platino en función del tratamiento que pudiera haber recibido previamente. Desde la reciente publicación de los estudios RUBY y KEYNOTE-868, la inmunoterapia ha mostrado unos resultados, que justifican su incorporación como parte del tratamiento en primera línea del cáncer de endometrio.
Los estudios GARNET con dostarlimab y el KEYNOTE-158 con pembrolizumab demostraron eficacia para el tratamiento de pacientes con cáncer de endometrio con pérdida del mecanismo de reparación de apareamiento de bases (MMRd) / inestabilidad de microsatélites alta (MSI-H) en recaída o avanzado que han progresado durante o después de un tratamiento previo basado en platino. También la publicación del estudio KEYNOTE-775 ha conseguido la aprobación de pembrolizumab en combinación con lenvatinib, para el tratamiento del cáncer de endometrio avanzado o recurrente en progresión durante o después de un tratamiento previo basado en platino, en cualquier contexto, y que no son candidatas a cirugía curativa o radioterapia.
Seguimiento
La mayor parte de las recaídas tienen lugar en los tres primeros años tras el diagnóstico. El objetivo del seguimiento consiste en una detección precoz de una recidiva de la enfermedad y adicionalmente permite controlar el impacto del tratamiento en la calidad de vida.
La mayoría de las recaídas son sintomáticas siendo el más frecuente la presencia de sangre en la orina (hematuria), sangre en las heces (rectorragia/hematoquecia) y sangrado vaginal; en caso de presentarse la paciente deberá remitirse a consulta para valoración.
Las revisiones vendrán determinadas en función al riesgo de recaída pero en general se llevarán a cabo cada 3-6 meses los dos primeros años tras la finalización del tratamiento y posteriormente al menos hasta el quinto año cada 6-12 meses.
Cada revisión debe incluir una serie de preguntas que nos puedan hacer sospechar de una recidiva local como saber si ha presentado sangrados, dolor, alteración del tránsito gastrointestinal o disuria. También debemos preguntar sobre efectos adversos a corto y largo plazo del tratamiento. Se debe aprovechar para fomentar hábitos de vida saludable en la consulta. Se debe proceder a una exploración física completa con palpación de cadenas ganglionares y exploración abdominal, la exploración ginecológica incluirá al menos exploración con espéculo, tacto bimanual y biopsia de cualquier lesión sospechosa de nueva aparición. La citología vaginal en el seguimiento del cáncer de cérvix no está recomendada considerándose incluso una práctica inadecuada. La determinación del marcador tumoral Ca125 en el seguimiento se puede considerar en aquellas pacientes con elevación al diagnóstico o histología serosa pero no forma parte del seguimiento habitual.
Las pruebas de imagen (radiografía de tórax, tomografía computarizada o ecografía abdominal) en pacientes asintomáticas detectan entre un 0-30% de las recidivas, por lo que no se recomiendan de manera sistemática. La idoneidad de la realización de alguna pruebas de imagen en el seguimiento también deberá ser valorado de manera individualizada como en casos estadio III-IV de la FIGO al diagnóstico que se puede recomendar la realización de una tomografía computarizada de tórax-abdomen-pelvis de manera semestral durante los 2-3 primeros años.
Efectos adversos a largo plazo del tratamiento:
Los efectos a largo plazo dependerán del tipo de tratamiento recibido.
La mayor parte de las mujeres son diagnosticadas durante la menopausia o la perimenopausia pero a algunas mujeres se les induce este proceso de una manera abrupta. La terapia hormonal sustitutiva que se usa habitualmente para reducir la síntomas de la menopausia está contraindicada. Otros de los riesgos de la menopausia es la pérdida de densidad mineral ósea por lo que es recomendable la realización de densitometrías óseas de manera periódica de cara a prevenir osteopenia y osteoporosis.
La cistitis tras la administración de radioterapia consiste en una sensación de quemazón al orinar y puede ocasionar urgencia miccional. El tratamiento con radioterapia o la propia cirugía puede dificultar el control del esfínter urinario ocasionando incontinencia urinaria. Se recomiendan medidas para fortalecimiento de los músculos del suelo pélvico. Los vasos sanguíneos de la vejiga tras el tratamiento son más frágiles y de manera episódica puede aparecer sangre en el orina sin que necesariamente esté relacionado con una recaída de la enfermedad.
La radioterapia a largo plazo o la propia cirugía debilitan los músculos del recto dando lugar a alteraciones del tránsito gastrointestinal, incontinencia o sangrado rectal. Puede ser recomendable valoración por el área de nutrición de cara a poder aconsejar ajustes en la dieta e incluso medicación.
La linfadenectomía (resección de ganglios linfáticos) puede ocasionar la presencia de linfedema en una o las dos extremidades inferiores que se desarrolla meses o años después de la cirugía. El riesgo de su desarrollo es aún mayor si dentro del tratamiento adyuvante la paciente recibió radioterapia. Aunque el linfedema puede ser permanente existen medidas para ayudar a su manejo. Su presencia aumenta el riesgo de infecciones cutáneas y ante cualquier enrojecimiento de la piel, aumento de la temperatura de la piel, aumento del perímetro de una pierna de manera súbita o dolor el paciente debe solicitar valoración médica.
La quimioterapia también ocasiona efectos adversos que se inician durante el tratamiento con platinos y taxanos en forma de neuropatía sensitivo-motora. Esta puede remitir meses después de finalizar el tratamiento o persistir a largo plazo. En función del grado de afectación puede ser necesario tratamiento farmacológico para el control del dolor.
El tratamiento con radioterapia en la región pélvica ocasiona una pérdida de elasticidad y estenosis vaginal a consecuencia de la fibrosis de los tejidos. Estos puede ocasionar dolor o sensación de disconfort durante la exploración médica pero también cuando la paciente desee mantener relaciones sexuales. El uso de dilatadores vaginales puede ayudar a evitar el estrechamiento de la vagina, se recomienda comenzar a usar estos dispositivos unas 4-6 semanas tras la finalización de la radioterapia o más tarde si aún persiste la inflamación del tejido. Los lubricantes vaginales no hormonales pueden resultar de ayuda. A nivel psicológico los principales problemas incluyen trastornos del estado de ánimo, estrés, ansiedad y pánico ante una posible recaída.




