Cáncer de cérvix
Índice de navegación
AUTORA: Dra. Luisa Sánchez Lorenzo
El aparato reproductor femenino está constituido por ovarios, trompas de Falopio, útero, cuello uterino y vagina. El cérvix o cuello uterino es la parte fibromuscular inferior del útero. Mide unos 3-4 cm de longitud aunque varía según la edad, número de partos y momento del ciclo menstrual.
 Se divide en dos partes. La más cercana al cuerpo uterino se llama endocérvix, cubierto por un epitelio cilíndrico productor de moco y la más cercana a la vagina es el ectocérvix o exocérvix, cubierta por un epitelio plano. La mayoría de los tumores se localizan en la unión entre el exocérvix y el endocérvix.
Se divide en dos partes. La más cercana al cuerpo uterino se llama endocérvix, cubierto por un epitelio cilíndrico productor de moco y la más cercana a la vagina es el ectocérvix o exocérvix, cubierta por un epitelio plano. La mayoría de los tumores se localizan en la unión entre el exocérvix y el endocérvix.
El cáncer de cérvix se inicia cuando las células sanas de su superficie comienzan a dividirse de manera descontrolada. Estos cambios condicionan anomalías, no necesariamente cancerosas. Estos son los primeros pasos que pueden dar lugar a la formación de un cáncer.
Epidemiología
El cáncer de cérvix es la 4º neoplasia más frecuente en mujeres a nivel mundial, se calcula que en 2020 se diagnosticaron unos 604.000 nuevos casos, suponiendo un 6.5% de los cánceres en mujeres y se registraron un total de 342.000 muertes. Las tasas de incidencia más altas se producen en África oriental, África Austral, África subsaharina, Melanesia, África occidental, Sudeste asiático y América del Sur . © International Agency for Research on Cancer 2020 Incidencia mundial de cáncer de cérvix
© International Agency for Research on Cancer 2020 Incidencia mundial de cáncer de cérvix
Se calcula que el 85-90% de las muertes tuvieron lugar en los países subdesarrollados, siendo la tasa de mortalidad 18 veces mayor en los países de ingresos bajos o medios respecto a los países ricos.
En España el cáncer de cérvix es la 15ª neoplasia más frecuente en mujeres con 1957 nuevos casos en 2020, aproximadamente con una incidencia de 5.3 casos/100.000 mujeres / año y una mortalidad de 1.5 casos/100.000 mujeres / año.

En un estudio que incluyó 38 países de los 5 continentes se mostró una sustancial disminución de la tasa de incidencia y mortalidad en los países con mayor tasa de ingresos, mientras estas tasas se estabilizaron o incluso aumentaron en aquellos países de bajos recursos.
El cribado de cáncer de cérvix es una estrategia de prevención efectiva y eficiente para prevenir el desarrollo del tumor. Desde sus inicios en 1940, la citología mediante técnica de Papanicolaou en combinación con el tratamiento en las primeras fases de la enfermedad ha disminuido hasta un 70% el porcentaje de muertes en los países desarrollados.
La citología mediante técnica de Papanicolaou tiene una baja sensibilidad para el diagnóstico de lesiones de alto grado pero compensa con una alta especificidad. La combinación de la detección molecular del virus del papiloma humano (VPH) y la citología alcanza una sensibilidad para detectar estas lesiones de hasta el 96%. En un escenario de vacunación como el que se está implantando, el cribado cubre a aquellas mujeres que no se vacunasen por diferentes motivos y también a aquellas con lesiones cervicales ocasionadas por un subtipo de VPH no incluido en las vacunas.
Causas y factores de riesgo
La infección crónica del VPH es la causa fundamental en más del 99% de los casos de cáncer de cérvix. Se consideran factores de riesgo todos aquellos relacionados con la adquisición de la infección. Hay otros cánceres relacionados con la infección crónica por VPH como el cáncer de vulva (46%), vagina (70%), anal (88%), pene (50%) y orofaringe (26-50% dependiendo de la región geográfica).
El VPH es la infección de transmisión sexual más común y la mayoría de la población sexualmente activa entra en contacto con el virus a lo largo de su vida. La infección es asintomática así que muchos de los infectados lo desconocen y por lo tanto lo pueden transmitir. Hasta un 90% de las infecciones por VPH se eliminan sin tratamiento durante los primeros dos años y sólo aquellas que se cronifican pueden dar lugar a lesiones precancerosas que progresen a cáncer invasivo.
Están descritas más de 130 variedades de VPH de los cuales al menos 14 se consideran como de alto riesgo para el desarrollo de cáncer. Los subtipos 16 y 18 causan aproximadamente el 70% de todos los cánceres. Algunos subtipos como 6 y 11 no están relacionadas con el desarrollo de cánceres pero si de verrugas genitales que son muy frecuentes y altamente contagiosas.
En una mujer con un sistema inmunocompetente el desarrollo del cáncer de cérvix puede llevar de 15 a 20 años, sin embargo, en aquellas mujeres inmunosuprimidas el tiempo de desarrollo de la enfermedad será significativamente menor, entre 5 y 10 años.
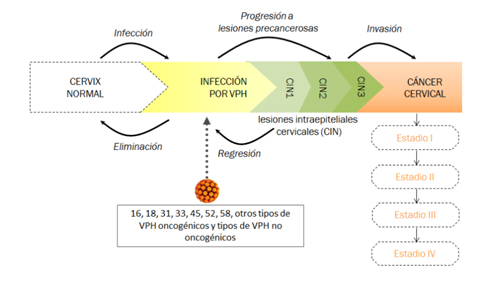 Esquema simplificado del modelo de simulación de Monte-Carlo que muestra los estados transitorios de salud de la historia natural de la infección por VPH y del cáncer de cérvix.
Esquema simplificado del modelo de simulación de Monte-Carlo que muestra los estados transitorios de salud de la historia natural de la infección por VPH y del cáncer de cérvix.
|
FACTORES DE RIESGO |
|
Edad temprana de inicio de las relaciones sexuales |
|
Promiscuidad sexual o parejas de alto riesgo |
|
Inmunosupresión (transplantadas, pacientes con enfermedades autoinmunes en tratamiento con esteroides, VIH, etc…) |
|
Antecedentes de co-infección por enfermedad de transmisión sexual. |
|
Uso de píldora anticonceptiva, porque suele llevar asociado no usar métodos barrera.
|
|
Falta de adherencia al programa de cribado poblacional |
|
Tabaquismo, duplican su riesgo respecto a las no fumadoras. |
|
Multiparidad y primer embarazo a una edad temprana |
|
Tipo de infección por VPH, debido al potencial oncogénico de cada subtipo.
|
|
Menos frecuente en pacientes cuyas parejas sexuales varones están circuncidados (estudios previos a la incorporación de la vacunación contra el VPH) |
Profilaxis
La profilaxis primaria se denomina a aquellas medidas aplicadas a personas sanas con intención de evitar la adquisición de la enfermedad.
La vacunación frente al VPH, al evitar la infección persistente y el desarrollo de lesiones preneoplásicas, se considera la mejor estrategia. Estas vacunas son realizadas a partir de la cubierta o cápsula del virus, constituidas por proteínas, entre ellas L1. Las tres vacunas están compuestas por estas proteínas L1 , elaboradas a partir de DNA recombinante, que se unen entre si de manera muy similar a la que está el VPH en la naturaleza; pero sin material genético viral (DNA viral). No pueden dar lugar a una infección u oncogénesis pero si son capaces de producir anticuerpos protectores exclusivamente contra los subtipos de VPH incluidos en la vacuna. Tienen un buen perfil de seguridad y habitualmente son bien toleradas. Las reacciones adversas descritas con mayor frecuencia son leves en el lugar de la inyección (dolor, eritema e inflamación), cefalea y en menor proporción fiebre.
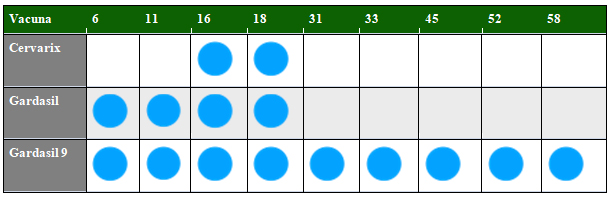
En junio de 2006 en EEUU y más tarde ese mismo año en Europa se aprobó Gardasil ® la primera vacuna dirigida contra 4 subtipos de VPH (6,11,16 y 18). Está aprobada desde los 9 años y se deben administrar 3 dosis intramusculares a los 0, 2 y 6 meses. En 2007 Cervarix ®, vacuna contra 2 subtipos de VPH (16,18) se aprobó primero en Europa y posteriormente en EEUU. Se considera segura desde los 9 años y se deben administrar dos dosis intramusculares si es <15 años y 3 dosis a los 0,1,6 meses si es > de 15 años. Actualmente la vacuna nonavalente Gardasil 9 ® (6, 11,16,18,31,33,45,52 y 58) aprobada en 2014 en Europa y EEUU es la que tras demostrar su eficacia se tiende a utilizar. Ya hay datos de inmunidad mantenida generada por estas tres vacunas a 8 y 10 años; pero el seguimiento de los pacientes incluidos en los diferentes ensayos clínicos que consiguieron la aprobación de estas vacunas nos permitirán saber si es precisa una revacunación.
Como el VPH es factor de riesgo de otro tipo de cánceres y no exclusivamente del cáncer de cérvix se recomienda la vacunación tanto de niñas y niños a partir de los 12 años y esta recomendación está incluida en el calendario vacunal en España. Se ha estimado que si con los programas de vacunación se alcanzaran tasas de vacunación del 70% en todo el mundo, la incidencia disminuiría en 344.520 casos al año y así se evitarían 178.182 muertes relacionadas con el cáncer de cérvix. En países como Australia, donde la tasa de vacunación es superior al 70%, ya se ha podido ver una reducción de la displasia de alto grado de un 38%. Hasta en Estados Unidos donde la tasa de vacunación es inferior, también se ha visto una reducción de la incidencia de displasia cervical del alto grado. Como la displasia de alto grado es un precursor necesario de los carcinomas escamosos, adenocarcinomas y carcinomas adenoescamosos del cuello uterino, esta disminución de la displasia cervical de alto grado se traducirá en una menor incidencia del cáncer de cuello cérvix en la próxima década.
Otra reciente publicación sueca que recoge el seguimiento de 1.672.983 niñas y mujeres de entre 10 y 30 años que recibieron la vacuna entre los años 2006 y 2017, también reforzó los datos de beneficio frente al cáncer invasivo de cérvix ya que de las diagnosticadas de cáncer de cérvix sólo 19 estaban vacunadas mientras que las 538 restantes no lo estaban. Pero aún así deben mantenerse los programas de cribado.
En las personas con condiciones de riesgo, tanto hombres como mujeres, también esta contemplada vacunación con tres dosis; incluyéndose en este grupo: síndrome de WHIM (enfermedad congénita que causa una inmunodeficiencia severa y el aumento de infecciones tanto bacterianas como víricas), infección por VIH (hasta los 26 años), personas en situación de prostitución (hasta los 26 años), hombres que tienen relaciones sexuales con hombres (hasta los 26 años) y mujeres que hayan tenido cirugía de cáncer de cérvix a cualquier edad.
Otras medidas de profilaxis primaria incluyen la abstinencia sexual, la monogamia o el uso de preservativos. Es importante destacar que el uso de preservativos reduce el riesgo entre un 60-70%, pero no protege zonas genitales no cubiertas y dependiendo del tipo de relación sexual zonas que estén potencialmente infectadas.
La profilaxis secundaria se define como la serie de medidas encaminadas a detectar la enfermedad en estadios precoces y por lo tanto un momento en el que con una serie de medidas adecuadas se puede impedir su progresión. Para el cáncer de cérvix esto implica un programa de cribado que incluye diferentes pruebas.
- Citología mediante técnica de Papanicolaou implantada desde los años 40 es una técnica fundamental dentro del programa de cribado consiguiendo una importante reducción de la morbimortalidad por cáncer de cérvix, hasta en un 70%. Se considera una prueba con baja sensibilidad (56%) para el diagnóstico de lesiones de alto grado, pero compensado por su altísima especificidad.
Para la realización de esta prueba no es precisa ninguna preparación específica pero si se dan ciertas recomendaciones que incluyen: evitar la realización de la prueba durante el ciclo menstrual, evitar tener sexo vaginal 2-3 días antes, evitar uso de tampones, cremas vaginales, lubricantes o medicación vía vaginal 2-3 días antes y evitar duchas vaginales 2-3 días antes. El médico debe colocar un espéculo en la vagina de manera que se tenga una correcta visualización del cuello uterino. Posteriormente se procede a un ligero raspado del ectocérvix con una pequeña espátula obteniéndose una muestra de células y mucosidad . A continuación se inserta a través del cuello uterino un pequeño cepillo o torunda de algodón para conseguir una muestra representativa del endocérvix. En caso de haber sido sometida previamente a una resección del cuello uterino (cervicotomía) o del útero (histerectomía) la muestra se tomará de las células de la parte superior de la vagina denominada manguito o muñón vaginal. Estas muestras son posteriormente analizadas al microscopio en búsqueda de anomalías en las células.
Como alternativa se puede ofrecer citología en base líquida porque disminuye el número de muestra insatisfactorias y requiere de menor tiempo de estudio microscópico. - Detección del VPH: tiene mayor sensibilidad que la citología y también alta especificidad. La combinación del Papanicolaou y la detección del VPH permite disminuir la tasa de falsos positivos.
- Inspección visual con ácido acéticopor su simplicidad y bajo requerimiento de material está aceptado en lugares con acceso médico limitado.
- Utilidad de la vacunación contra VPH como método de profilaxis secundaria:
- Si la lesión ha sido producida por un subtipo de VPH no incluido en la vacuna esta protegerá contra otros tipos, que si estén incluídos en la vacuna.
- Si la lesión ha sido producido por un subtipo de VPH incluido en la vacuna esta protegerá contra el resto de los subtipos.
- Si la lesión es producida por un subtipo de VPH vaginal la vacuna conseguirá protección contra la reinfección/reactivación.
Anatomía Patológica
- Lesiones Escamosas del Cuello Uterino:
- Lesión Intraepitelial Escamosa de alto grado (H-SIL): incluye lesiones con displasia moderada o severa, CIN 2 y CIN 3. Las lesiones HSIL/CIN2 tienen tienen similar riesgo de remitir como de progresar a cáncer de cérvix. Las lesiones HSIL/CIN3 se consideran de elevado riesgo de progresión y se consideran la lesión precursora necesaria para el desarrollo del cáncer de cérvix.
- Lesiones Glandulares del Cuello Uterino:
- Lesiones intraepiteliales glandulares (adenocarcinoma in situ): se considera la lesión precursora del adenocarcinoma invasor.
- Carcinoma de cuello uterino:
- El adenocarcinoma es el segundo subtipo histológico más frecuente (20-25%) se caracteriza por la formación de estructuras glandulares. Su origen suele estar en el endocérvix. Entre los subtipos histológicos más frecuentes se incluyen el adenocarcinoma convencional, mucinoso, villoglandular, de células claras y seroso
- Existen histologías infrecuentes (<5%) que incluyen al carcinoma neuroendocrino de cérvix, adenosarcoma y leiomiosarcoma entre otros.
Signos y síntomas
En los estadios tempranos la enfermedad es con frecuencia asintomática.
Los síntomas más precoces incluyen:
- Sangrado genital anómalo (irregular/intermitente).
- Sangrado tras relaciones sexuales (coitorragia) o durante el examen ginecológico.
- Flujo maloliente, es muy inespecífico, pero puede ser indicativo de vaginitis o cervicitis.
- Dolor pélvico o lumbar.
- Molestias al orinar (disuria) o tenesmo rectal.
- Sangrado ginecológico tras la menopausia.
- Dolor durante las relaciones sexuales (dispareunia).
- Sangre en la orina o sangre en las heces.
- Pérdida de peso, cansancio y pérdida de apetito.
- Edema de una o ambas piernas sin otras causas que lo justifiquen.
Diagnóstico
1. Exploración física y ginecológica: se realiza un examen visual del cérvix con espéculo. Aquellas lesiones visibles con esta técnica incluyen ulceraciones, tumores exofíticos en el exocérvix e infiltración del endocérvix. Se suele acompañar de un examen recto-vaginal para hacer una aproximación del tamaño de la lesión o si se sospecha infiltración de tabique recto vaginal y parametrios. No se debe olvidar realizar palpación de los territorios ganglionares.
2. Citología cervical (Papanicolaou): es el principal método de método de cribado poblacional. Identifica células anormales. Sensibilidad baja pero alta especificidad. Es más sensible para lesiones de estirpe escamosa.
3. Prueba de VPH: prueba de alta sensibilidad y especificidad. Las pruebas pueden ser de 3 tipos:
- Detección del DNA viral que asociada a la citología mejora la detección de lesiones precursoras.
- Detección del RNA de los genes E6 y E7 del VPH, como inconveniente tiene mayor tasa de falsos positivos.
- Detección de marcadores celulares que buscan ciertas proteínas con expresión aumentada con la infección del VPH. Consigue disminuir los falsos positivos en combinación con el Papanicolaou.
4. Colposcopia: se realiza cuando alguna de las pruebas de cribado resulta positiva o si existe sospecha clínica. Permite ver con mayor detalle la morfología de lesiones sospechosas y en el mismo acto tomar biopsias.
5. Biopsia cervical: consiste en la toma de un pequeño fragmento de la lesión sospechosa para corroborar el diagnóstico de sospecha.
6. Determinaciones analíticas: tienen mayor utilidad cuando existe enfermedad avanzada localmente o a distancia, prestando especial atención a la función renal y hepática.
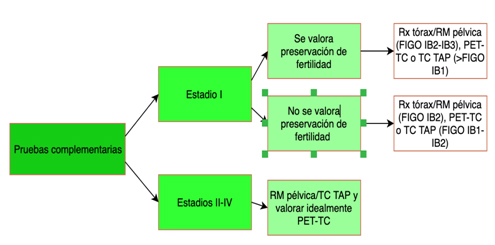
7. Pruebas de imagen:
- Radiografía de tórax: permite valorar la presencia de metástasis pulmonares con ciertas limitaciones.
- Cistoscopia y/o rectosigmoidoscopia: consiste en realizar una visualización directa de vejiga y recto respectivamente ante la sospecha de infiltración por el tumor. En el mismo procedimiento se pueden tomar biopsias.
- Urografía: permite valorar las vías urinarias ante la sospecha de enfermedad localmente avanzada.
- Ecografía transvaginal: es de gran utilidad para valorar la cavidad endometrial y en manos de un experto puede aportar mucho información sobre la extensión de la enfermedad.
Todas estas técnicas se han utilizado de manera clásica pero en nuestro medio quedan relegadas en favor de pruebas de imagen más avanzadas que nos permiten un diagnóstico de extensión más preciso como:
-Tomografía Computarizada (TC): se puede utilizar en lugar de la radiografía de tórax y urografía para el estadiaje y también resulta de utilidad para la valoración de la afectación ganglionar.
- Resonancia Magnética: prueba de gran utilidad para la estadificación local de la enfermedad determinando el tamaño del tumor, la invasión de tejidos adyacentes y la afectación ganglionar.
- Tomografía por emisión de positrones (PET) o PET-TC: ofrece un mapa metabólico de la enfermedad. Permite delimitar de manera fiable la extensión de la enfermedad y es de especial utilidad para detectar la afectación ganglionar.
Es muy importante adecuar las pruebas solicitadas a la sospecha clínica.
Estadificación
El estadiaje de un tumor nos permite poder definir con claridad su tamaño, localización, extensión local y a distancia (metástasis). Realizar un adecuado proceso de estadificación con todas las pruebas precisas es fundamental para el equipo multidisciplinar ya que en base a esta información puede diseñar la estrategia terapéutica que se va a utilizar. Los dos sistemas de clasificación utilizados son el sistema TNM y el FIGO estando este segundo más extendido, pero existiendo correlación entre ambos. La última actualización del sistema FIGO se llevó a cabo en 2018, siendo el que utilizamos en la actualidad.
|
Estadificación de cáncer de cérvix FIGO 2018 |
|
|
Estadio I |
Enfermedad confinada al cérvix uterino. |
|
IA |
Carcinoma invasivo con diagnóstico microscópico, profundidad máxima <5mm. |
|
IA1 |
Invasión estromal <3mm de profundidad. |
|
IA2 |
Invasión estromal ≥ 3mm y <5 mm de profundidad. |
|
IB |
Carcinoma invasivo con profundidad ≥5mm pero lesión limitada el cérvix. |
|
IB1 |
Carcinoma invasivo ≥5mm de profundidad y <2cm en su diámetro mayor. |
|
IB2 |
Carcinoma invasivo ≥2cm pero <4cm de diámetro mayor. |
|
IB3 |
Carcinoma invasivo ≥ 4cm de diámetro mayor. |
|
Estadio II |
Tumor que invade más allá del cérvix sin llegar al tercio inferior de la vagina o a la pared pélvica. |
|
IIA |
Invasión limitada a los dos tercios superiores de la vagina pero sin afectación parametrial. |
|
IIA1 |
Carcinoma invasivo ≤ 4cm de diámetro mayor. |
|
IIA2 |
Carcinoma invasivo > 4cm de diámetro mayor. |
|
IIB |
Invasión del parametrio sin llegar a la pared pélvica |
|
Estadio III |
Tumor que invade el tercio inferior de la vagina y/o pared pélvica y/o causa ureterohidronefrosis o riñón no funcionante y/o afecta a ganglios pélvicos y/o paraaórticos. |
|
IIIA |
Se extiende hasta el tercio inferior de la vagina, sin afectación de la pared pélvica. |
|
IIIB |
Se extiende hasta la pared pélvica y/o ureterohidronefrosis o riñón no funcionante (excluidas otras causas) |
|
IIIC |
Diseminación ganglionar pélvica y/o paraaórtica (incluyendo micrometástasis) independientemente del tamaño del tumor primario |
|
IIIC1 |
Afectación metastásicas de ganglios pélvicos exclusivamente |
|
IIIC2 |
Afectación metastásica de ganglios paraaórticos |
|
Estadio IV |
Tumor que se extiende más allá de la pelvis y/o ha alcanzado la mucosa de la vejiga o del recto ( precisa biopsia) |
|
IVA |
Diseminación a órganos adyacentes |
|
IVB |
Diseminación a órganos distantes |
Factores pronósticos
Tratamiento
Tratamiento de lesiones preinvasivas (CIN)
Son detectadas normalmente dentro de los programas de cribado. No se consideran un cáncer pero si no se tratan estas células anormales pueden acabar transformándose en uno en el futuro.
Las lesiones CIN1 no precisan tratamiento salvo las excepciones recogidas en la tabla.
Las lesiones CIN2-3 precisan de tratamiento quirúrgico cuya técnica puede variar en función de las características de la paciente. Las más frecuentes incluyen resección con asa diatérmica o conización.
|
Tratamiento quirúrgico de las lesiones preinvasivas |
|
|
ESCISIONAL/DESTRUCTIVO |
HISTERECTOMÍA |
|
CIN1/LSIL persistente durante 2 años |
Adenocarcinoma in situ sin deseo gestacional |
|
Biopsia de LSIL/CIN1 endocervical precedido de citología de HSIL |
CIN2-3/HSIL en el que no es posible realizar un procedimiento conservador. |
|
CIN2-3/HSIL |
CIN2-3/HSIL persistente o recurrente con deseo genésico cumplido e imposibilidad de realizar un nuevo procedimiento escisional. |
|
CIN2/HSIL <25-30 años y persistencia durante 2 años |
|
|
Adenocarcinoma in situ con deseo gestacional |
|
|
Embarazada sólo si sospecha de invasión |
|
|
CIN1/LSIL con imposibilidad para seguimiento |
|
La elección de la técnica dependerá de la lesión detectada pudiendo ser:
- Tratamiento escisional: reseca toda la lesión para evaluarla histológicamente.
- Tratamiento destructivo: elimina completamente la lesión resecada. Se propone si no hay ningún signo de sospecha de microinvasión, neoplasia glandular o afectación endocervical.
- Crioterapia actualmente limitada a casos de CIN1/LSIL o medios con recursos limitados.
- Vaporización con láser de CO2: precisa de un intenso aprendizaje pero con alta tasa de curación de CIN3/HSIL (95-98%). Es de elección en lesiones extensas que afecten a los fondos vaginales.
Tratamiento de lesiones invasivas
En pacientes con estadios iniciales de la enfermedad algo que tenemos que plantearle es si ya ha cumplido sus deseos genésicos. Para podernos plantear una cirugía con preservación de la fertilidad debemos exponerle con claridad los riesgos oncológicos y obstétricos. No está recomendado en aquellos subtipos histológicos raros, tumores de >2cm, si hay márgenes afectos o afectación de ganglios linfáticos. Cualquier embarazo tras este tipo de cirugía se considera de alto riesgo y el parto sólo podrá ser por cesárea.
En caso de afectación ganglionar positiva el estadio FIGO será mayor, por lo que se recomendaría tratamiento quimioterápico con cisplatino endovenoso en esquema semanal (entre 5-6 ciclos) concomitante con radioterapia. En pacientes estadio IA sin invasión linfovascular en una paciente que no pueda ser sometida a cirugía se puede plantear tratamiento con braquiterapia (radioterapia interna aplicada con un dispositivo especial).
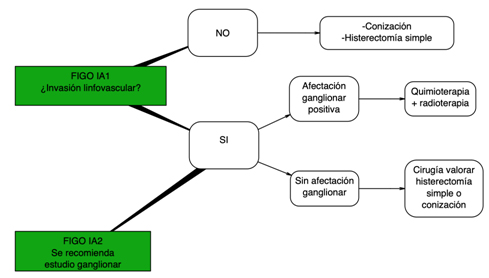
Existe gran controversia respecto al modo de abordaje quirúrgico de cara a la histerectomía, si se debe continuar con el abordaje mínimamente invasivo con laparoscopia/cirugía robótica o si optar por la tradicional cirugía abierta. El estudio LACC demostró que el abordaje mínimamente invasivo tiene mayor tasa de recidiva y peor supervivencia global en comparación con la cirugía abierta.
Estos resultados suscitaron un importante debate, dando lugar a otros estudios que buscaron validar los resultados. En un subestudio del estudio retrospectivo SUCCOR, en el que se valoraba el papel de la conización cervical preoperatoria a la hora de realizar una histerectomía radical, se observo que las pacientes conizadas recaían menos. Las pacientes con conización previa y cirugía mínimamente invasiva por cirugía laparoscópica o robótica no habían presentado diferencias estadísticamente significativas con respecto a aquellas pacientes que se habían intervenido pro cirugía abierta; sugiriendo esto que la conización preoperatoria aparentemente puede proteger en aquellos tumores pequeños.
En estadios iniciales una vez realizada la histerectomía radical se deben valorar los factores pronósticos. Se consideran de riesgo intermedio aquellos con tumores >4cm, invasión linfovascular o infiltración estromal profunda proponiéndose en estos casos radioterapia adyuvante. Los de alto riesgo son los que tienen márgenes afectos, infiltración parametrial o afectación ganglionar recomendándose tratamiento con quimioterapia y radioterapia adyuvante.
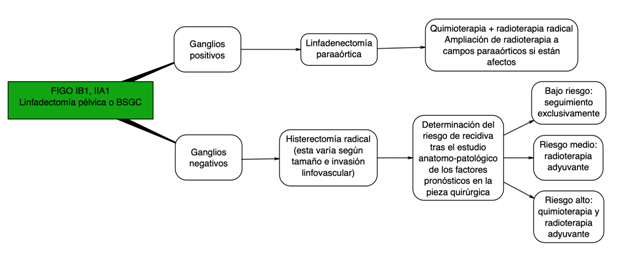
Tratamiento de la enfermedad localmente avanzada
Se recomienda tratamiento de quimioterapia, cisplatino endovenoso en esquema semanal al menos por 5-6 ciclos, concomitante con radioterapia externa. Posteriormente la paciente debe recibir tratamiento con braquiterapia y en caso de no disponer de ella en su centro debe ser remitida a uno de referencia. El esquema más empleado es el de dos implantes uno por semana con dos aplicaciones cada semana separadas por 1-2 días.
El estudio OUTBACK, publicado en 2021, demostró que la quimioterapia adyuvante administrada después de la quimio-radioterapia estándar basada en cisplatino en mujeres con cáncer de cérvix localmente avanzado, no mejoró la supervivencia global ni la supervivencia libre de progresión.
También resultó negativo para su objetivo principal el estudio CALLA, publicado en 2022, en el que Durvalumab administrado simultáneamente a la quimio-radioterapia en mujeres con cáncer de cérvix localmente avanzado no mejoró significativamente la supervivencia libre de progresión frente a la quimio-radioterapia estándar.


Tratamiento de la enfermedad disenimada y las recaídas
Llamamos enfermedad diseminada o metastásica a aquellos casos estadio IVB de la FIGO. Las localizaciones metastásicas a distancia más frecuentes son pulmonar, hepática, peritoneal suprarrenal, intestinal y cutánea. El objetivo en estas pacientes es el control sintomático y buscar conseguir una mejor calidad de vida. Por lo tanto la paciente debe tener un aceptable estado general, en caso de no ser así el tratamiento puede generar un significativo deterioro de calidad de vida.
El tratamiento estándar se basa en una combinación de cisplatino y paclitaxel. En algunas pacientes se puede valorar la combinación de carboplatino y paclitaxel o según comorbilidades previas o deterioro de la función renal se puede optar por un esquema no basado en platino con topotecan y paclitaxel.
La proliferación vascular tiene un importante papel en la progresión del cáncer de cervix. El bevacizumab es un anticuerpo que impide la proliferación vascular y forma parte del tratamiento en primera línea estándar para la enfermedad metastásica ya que ha demostrado beneficio en supervivencia global y supervivencia libre en progresión en base al estudio GOG-240. Es importante saber que hay ciertas contraindicaciones para el uso del bevacizumab como la hipertensión arterial no controlada, el evento tromboembólico previo o el riesgo de perforación/fístula en función de tratamientos previos y localización del tumor.
En 2021 se publicó el KEYNOTE-826 que demostró en pacientes con cáncer de cérvix persistente, recurrente o metastásico, que la adición de pembrolizumab a la quimioterapia (QT) con o sin bevacizumab una mejora estadísticamente en la supervivencia global y supervivencia libre en progresión en las pacientes aleatorizadas. Se limita su uso en pacientes con PD-L1 CPS ≥1, porque el estudio no tuvo potencia suficiente para la comparación entre los grupos de tratamiento con PD-L1 CPS<1.
En caso de recaída es fundamental conocer la localización. Si esta fuera pélvica central y resecable, en función del tratamiento previo y el intervalo desde su finalización, se podría valorar un rescate quirúrgico en forma de exenteración pélvica ( cirugía compleja que incluye resección de útero, vagina, colon inferior, el recto y/o la vejiga en función de la afectación).

En caso de recaída a distancia el planteamiento sería ofrecer algún ensayo clínico según disponibilidad o iniciar una nueva línea de tratamiento ya sea con quimioterapia o inmunoterapia (cemiplimab o pembrolizumab). Existen algunos casos en los que se puede plantear una exenteración pélvica sólo con fines paliativos y se orienta para aquellas pacientes con una recidiva incurable pero mala calidad de vida por dolor, la presencia de fístulas, necrosis o sangrado.
Pacientes embarazadas
Se trata de algo infrecuente, pero estos casos deben ser manejados en centros con experiencia y una buena unidad de neonatología.
El tratamiento vendrá condicionado por el estadio de la enfermedad y la fase del embarazo. En algunas ocasiones es posible retrasar el tratamiento hasta después del parto. En los casos cuyo tratamiento no se puede demorar la quimioterapia basada en platino con o sin paclitaxel se pueden proponer a partir del segundo trimestre de gestación. La radioterapia está contraindicada durante el primer trimestre y sobre la pelvis también entre las semanas 18-38 por el riesgo de malformaciones; descartándose como parte del tratamiento.
En pacientes con cánceres estadio IA1 se puede plantear un parto por vía vaginal aunque la cesárea después de la 32 semana es de elección para la mayoría de las pacientes.
Seguimiento
Aproximadamente el 30% de las pacientes con cáncer de cérvix sufrirán una recaída tras recibir un tratamiento óptimo. Hasta un 75% de las recidivas ocurren en los 3 años siguientes al diagnóstico. La localización más frecuente es pélvica y a nivel ganglionar paraórtico. El riesgo depende del estadio al diagnóstico.
Los protocolos de seguimiento tienen como objetivo detectar lo antes posible la recidiva de manera que pueda ser susceptible de recibir un tratamiento con intención curativa.
En el caso del cáncer de cérvix no ha demostrado su eficacia, esto hace que sea complicado establecer la periodicidad y saber cuales son las pruebas complementarias más adecuadas, habitualmente se hace en función al riesgo del paciente.
Existen ciertos síntomas ante los cuales la paciente se debe remitir a consulta para valoración ya que son sugestivos de recidiva incluyendo: sangrado vaginal, dolor pélvico o abdominal, síntomas urinarios, rectorragia o hematoquecia y alteraciones de tránsito gastrointestinal.
Cada revisión debe incluir una serie de preguntas que nos puedan hacer sospechar de una recidiva local como saber si ha presentado sangrados, dolor o secreción maloliente o recidiva sistémica como cansancio, aumento de dolor óseo, pérdida de peso, pérdida de apetito y cansancio. La determinación de marcadores tumorales no ha demostrado utilidad en el seguimiento. También se debe proceder a una exploración física con palpación de cadenas ganglionares y exploración abdominal, con revisión previa por parte de ginecología. La citología anual dependerá del tipo de tratamiento recibido previamente, no siendo aconsejable sistemáticamente en pacientes con radioterapia previa. Se recomienda la determinación de VPH ya que si es de un subtipo de alto riesgo está asociado a un mayor riesgo de recaída, sobre todo en aquellas pacientes sometidas a cirugías de preservación de fertilidad.
La primera revisión se recomienda a los 3-6 meses del fin de tratamiento, incluyendo una prueba de imagen PET-TC o TC de tórax-abdomen-pelvis para aquellas con un estadio FIGO II o superior.
Durante los dos primeros años a las pacientes de alto riesgo se recomienda examen físico y ginecológico cada 3 meses y si son de bajo riesgo de manera semestral. Desde los 3 hasta los 5 años seguimiento semestral y desde los 5 años revisión anual.
Se recomienda realizar Rx de tórax anual pero el resto de la pruebas complementarias deben ser en función de la sintomatología.
Efectos adversos a largo plazo del tratamiento
La radioterapia a largo plazo debilita los músculos del recto dando lugar a alteraciones del tránsito gastrointestinal, incontinencia o sangrado rectal.
Sobre unos dos años después del final de la radioterapia puede comenzar el linfedema en extremidades inferiores cuyo riesgo es mayor si dentro del tratamiento previo se llevó a cabo una linfadenectomía.
La quimioterapia también ocasiona efectos adversos que se inician durante el tratamiento con platinos y taxanos en forma de neuropatía sensitivo-motora. Esta puede remitir meses después de finalizar el tratamiento o persistir a largo plazo.
La histerectomía aumenta el riesgo de incontinencia urinaria y prolapso vaginal incluso años después de la cirugía por debilidad de los músculos del suelo pélvico. Se debe recomendar la realización de actividad física orientada a fortalecer esta musculatura.
Muchas de las pacientes tratadas son jóvenes y el tratamiento impacta en su vida sexual. Inicialmente la radioterapia puede provocar dolor, eritema o sangrado que con el tiempo dará lugar a una fibrosis de la vagina. Es importante animar a la pacientes a usar dilatadores plásticos desde que finaliza el tratamiento. Estas medidas facilitarán no sólo las relaciones sexuales sino también la exploración ginecológica. Hasta 5 años después de finalizar el tratamiento las pacientes se quejan de la falta de deseo o satisfacción con las relaciones. A nivel psicológico los principales problemas incluyen trastornos del estado de ánimo, estrés, ansiedad y pánico ante una posible recaída.




