Melanoma
AUTOR: Dr. Iván Márquez Rodas
en colaboración con los Doctores José Antonio Avilés, Enrique Mercader,
José Luis Escat, Verónica Parra y Ana Álvarez, del Comité Multidisciplinar de Melanoma
Introducción
Si está leyendo este documento, es posible que a usted, a alguien de su familia o de su entorno le hayan diagnosticado de un melanoma y quiera buscar más información. En este documento intentaremos ayudarle a aclarar los procedimientos, por los cuales, un paciente con melanoma puede necesitar pasar. Estos pasos, que son el diagnóstico, clasificación y tratamiento del melanoma, de forma ideal, debe realizarse por equipos multidisciplinares y coordinados, en el que podrán participar dependiendo de las circunstancias, dermatólogos, cirujanos, patólogos, radiólogos, médicos nucleares, oncólogos médicos y oncólogos radioterápicos, así como equipos de enfermería, entre otros profesionales sanitarios.
El siguiente documento no pretende (ni puede) sustituir a los consejos que sus médicos van a darle en las distintas etapas del diagnóstico y del tratamiento. Tampoco pueden constituir una guía clínica reglada, sino que son un apoyo que intentamos darle para entender el proceso.
No dude en consultar a sus médicos si tiene dudas, ya que somos conscientes de que es difícil entender toda la información que los médicos les damos en la primera consulta de una sola vez.
¿Qué es un melanoma? Definición y causas
El melanoma es un tumor cuyo origen está en unas células llamadas melanocitos. Estas células producen la melanina, que es el pigmento que da color a nuestra piel y que permite protegerla de los rayos ultravioleta.
La gran mayoría de melanomas suceden en la piel expuesta al Sol, ya sea por una exposición continuada (por ejemplo, personas que trabajan al aire libre en zonas de exposición solar, como el campo) o ya sea por exposiciones intermitentes (quemaduras solares en playa, piscina, o cualquier lugar cuando se toma el sol, por ejemplo). Hay también un mayor riesgo de melanoma en las personas que usan cabinas de rayos UVA artificiales.
Cuando los daños producidos por esta radiación superan a la capacidad que nuestro propio cuerpo tiene de repararlos, se producen mutaciones en estas células que hacen que pierdan el control de su proliferación (la capacidad de multiplicarse). Si esta proliferación no es detenida por las propias células o si el sistema inmune no es capaz de detectarlas y destruirlas, entonces el melanoma aparece. En torno a un 90% de melanomas aparecen en la piel, y de ellos aproximadamente en un 75-80% de los casos el melanoma aparece sin que haya habido un lunar previo.
¿A cuántas personas afecta? ¿Hay forma de prevenirlo? Epidemiología y prevención
Según datos de la Sociedad Española de Oncología Médica (SEOM), en España se diagnostican al año unos 6.179 casos nuevos al año de melanoma de piel. Es uno de los tumores que más está aumentando en incidencia en occidente, debido probablemente a los hábitos de exposición solar y quizá también a una mayor concienciación de la población que consulta más a sus dermatólogos ante aparición de lesiones en la piel.
La mejor prevención es una exposición responsable al sol. Hay que evitar la exposición prolongada sobre todo en las horas centrales del día, y usar cremas con factor protector alto en las zonas expuestas al sol (sobre todo en verano). Esto es especialmente importante en personas con piel clara y en los niños, ya que sabemos que las quemaduras solares en la infancia son uno de los mayores factores de riesgo para que aparezca un melanoma.
Existen una serie de factores de riesgo además de la exposición solar, que son:
-
- Edad: puede aparecer a cualquier edad, siendo cada vez diagnosticados en edades más jóvenes, aunque algo más de la mitad se diagnostican a partir de los 55 años.
- Sexo: es algo más frecuente en las mujeres, aunque suele tener mejor pronóstico.
- Coloración piel y cabello: cuánto más clara es la piel, ojos y pelo, más riesgo existe de melanoma. Este riesgo es especialmente alto en personas rubias y pelirrojas. Las personas de piel oscura tienen menos incidencia de melanoma cutáneo, si bien hay mayor proporción de unos tipos más raros de melanoma, llamados acrales (ver más adelante), así como de melanomas en regiones mucosas.
- Presencia de nevus/lunares: sólo un 20-25% de los melanomas surgen de un lunar (nevus) previo, la mayoría aparecen sobre la piel normal. A mayor número de nevus y sobre todo si son de gran tamaño y presentes desde el nacimiento (congénitos) se incrementa el riesgo de melanoma. Como prevención debemos estar alertas ante la aparición de cualquier lunar que no tuviéramos previamente, o bien algún cambio de los lunares respecto al tamaño, color, forma, textura o sangrado.
Existe una regla sencilla, el ABCDE, que resume las características de sospecha de una lesión cutánea pigmentada:
-
- A: Asimetría. La lesión NO es redondeada.
- B: Bordes. Los bordes son irregulares.
- C: Color. La lesión presenta distintos colores, no homogéneos.
- D: Diámetro. El tamaño de la lesión es mayor de 6 mm.
- E: Evolución. Cualquiera de las características anteriores ha presentado cambios en el tiempo.
En esta imagen, tomada de la página web de la Asociación Española Contra el Cáncer, se describen estos signos.
 Fuente: https://www.aecc.es/es/todo-sobre-cancer/tipos-cancer/cancer-piel/melanoma/sintomas
Fuente: https://www.aecc.es/es/todo-sobre-cancer/tipos-cancer/cancer-piel/melanoma/sintomas
-
- Factores Genéticos: ver punto 3.
- Inmunodepresión: hay mayor riesgo de tener melanoma en pacientes con leucemias, linfomas, trasplantes de órganos, infección por VIH o cualquier otra situación de inmunosupresión patológica o provocada por medicación.
¿Puede afectar a mi familia? Consejo genético en melanoma
Un estudio del Grupo Español de Melanoma ha determinado que aproximadamente un 7% de los casos de melanoma tienen algún criterio de riesgo familiar. Esto no significa que todos esos casos tengan un factor hereditario, ya que conocemos en torno a un 20-25% de las causas genéticas que están detrás de los casos que tienen factores de riesgo hereditario, que son:
-
- Múltiples casos en la familia, sobre todo relacionados en primer grado (padres, hijos, hermanos).
- Múltiples melanomas en un mismo individuo.
- Asociación a otros tumores, tales como el cáncer de páncreas.
Ante la presencia de algunos de estos factores de riesgo hereditario, se recomienda la derivación a una unidad de consejo genético oncológico que tenga además acceso a unidades de dermatología especializadas en lesiones pigmentadas. Los genes que habitualmente se estudian en personas con estas características son:
-
- CDKN2A: relacionado con melanoma y en algunos casos con cáncer de páncreas.
- CDK4: relacionado con melanomas (más raro encontrar mutaciones en este gen).
- M1CR: relacionado con la pigmentación cutánea, sus mutaciones son factor de riesgo y aumentan el riesgo en personas que además tienen mutaciones en CDKN2A.
¿Son todos los melanomas iguales? Tipos y biología molecular básica del melanoma. Mutación en BRAF
Aunque la mayoría de melanomas aparecen en la piel, y la mayoría de ellos sobre piel previamente expuesta al sol, existen otros subtipos de melanoma que no tienen relación con la exposición solar, y son:
-
- Melanoma acral: suelen aparecer en zonas distales del cuerpo, tales como palmas de manos y pies o debajo de las uñas. Suelen presentarse de una forma más avanzada, afectar más a personas con piel oscura y, en general, se siguen los mismos procedimientos diagnósticos y de tratamiento que en el melanoma cutáneo.
- Melanoma de mucosas: son más raros, se pueden presentar en la mucosa nasal, cavidad orofaríngea, aparato genital, aparato urinario o aparato digestivo. Dada su localización y rareza, son difíciles de diagnosticar.
- Melanoma uveal u ocular: son muy raros y afectan a la capa interna del ojo (coroides) en la mayoría de casos, siendo más raro que afecte al iris (la zona que da color a los ojos). Tienen un tratamiento muy específico en fases iniciales que requiere una gran coordinación entre oftalmólogos y oncólogos radioterápicos (en concreto con tratamientos sofisticados con braquiterapia o partículas pesadas), por lo que ante el diagnóstico es recomendable que los pacientes sean tratados en centros con amplia experiencia.
El melanoma es un tumor que tiene una gran complejidad molecular, siendo el tumor, o uno de los tumores, con mayor proporción de mutaciones. Estudiar algunas de estas mutaciones es importante a la hora de establecer estrategias de tratamiento, siendo sin lugar a dudas hoy en día fundamental el estudio de la presencia o ausencia de mutaciones en el oncogen BRAF, sobre todo cuando el melanoma se presenta con metástasis (ya sea en ganglios, ya sea en otros órganos). Esta mutación se estudia en el tumor (no en el paciente), y puede ser realizada en el tumor primario o en alguna metástasis si la hubiera.
Entre un 40-50% de los pacientes tienen en su melanoma mutación en BRAF, siendo la más frecuente la mutación BRAF V600E, seguida de la BRAF V600K, las cuales son detectadas por la inmensa mayoría de equipos dedicados a este diagnóstico molecular. Si bien la presencia de esta mutación estaba asociada a quizá un peor pronóstico, la importancia de conocer la misma es, como se verá más adelante, saber si en determinadas circunstancias en las que hay metástasis el paciente se puede beneficiar o no de un tratamiento especial que se denomina terapia dirigida (ver puntos 10 y 11).
Tengo un informe de anatomía patológica de mi melanoma. ¿Qué significan los distintos apartados? Anatomía patológica. El sistema de clasificación TNM
Una vez que su dermatólogo, tras sospecha de diagnóstico de melanoma ha procedido a una biopsia y esta es positiva para melanoma, existe una información inicial que va a ser importante para los siguientes pasos de lo que denominamos estadificación. Esta estadificación sigue los criterios internacionales llamados AJCC en su actual edición número 8.
De forma resumida, hay 4 estadios posibles del melanoma: I, II, III y IV. La clasificación en cada uno de estos estadios va a depender de tres factores que se denominan TNM. T hace referencia a la extensión local del propio melanoma, N hace referencia a los ganglios (y a unas metástasis especiales, llamadas en tránsito) y M a las metástasis en otros órganos.
T: características del melanoma
La información básica que aparecerá en un informe de anatomía patológica es la siguiente:
-
- Espesor de Breslow: es la medición de la capacidad invasora en profundidad del melanoma y se mide en milímetros. A mayor índice de Breslow, mayor riesgo de afectación de ganglios y/o de metástasis a distancia. También nos orientará a qué tamaño debe tener una posterior ampliación de márgenes (en una segunda intervención, para estar seguros de que se extirpa todo el melanoma) así como de la necesidad de realizar o no el ganglio centinela. Si este espesor es 0, se denomina melanoma in situ (Tis).
- Ulceración: es la presencia o no de erosión en la capa epidérmica. Su presencia se asocia a un peor pronóstico.
- Satelitosis microscópicas: son nidos de células tumorales separados del tumor primario pero que no se pueden detectar con la exploración física. Se correlacionan con un peor pronóstico y actualmente ya se consideran iguales en términos de estadificación que las metástasis en tránsito, por lo tanto su presencia hace que el melanoma se clasifique como estadio III (ver siguientes apartados).
- Espesor de Breslow: es la medición de la capacidad invasora en profundidad del melanoma y se mide en milímetros. A mayor índice de Breslow, mayor riesgo de afectación de ganglios y/o de metástasis a distancia. También nos orientará a qué tamaño debe tener una posterior ampliación de márgenes (en una segunda intervención, para estar seguros de que se extirpa todo el melanoma) así como de la necesidad de realizar o no el ganglio centinela. Si este espesor es 0, se denomina melanoma in situ (Tis).
-
- Niveles de invasión de Clark: existen 5 niveles, siendo su interpretación más subjetiva. Actualmente ya no se utiliza para la estadificación pero en la mayoría de informes aparece como una información adicional.
- Índice mitótico: es una medida de la proliferación del melanoma, y se mide por número de mitosis por mm2. Sigue teniendo importancia pronóstica (a mayor número de mitosis, peor pronóstico) pero ya no se utiliza para la estadificación del melanoma.
- Subtipo histológico: describe el tipo de melanoma, siendo el más frecuente el de extensión superficial aunque también pueden describirse otras formas como el nodular, el lentiginoso acral, el desmoplásico u otros, si bien tampoco cambian la clasificación.
- Infiltración linfocitaria: la presencia de linfocitos en el melanoma (una clase de células de nuestro sistema inmune) se ha asociado con mejor pronóstico.
- Invasión perineural: es más frecuente en el melanoma desmoplásico y tiene mayor frecuencia de recurrencia local.
- Regresión: aparentemente confiere peor pronóstico.
- Niveles de invasión de Clark: existen 5 niveles, siendo su interpretación más subjetiva. Actualmente ya no se utiliza para la estadificación pero en la mayoría de informes aparece como una información adicional.
Los datos previos se obtienen al extirpar el melanoma, pero como luego se realiza ampliación de márgenes y en algunos casos determinación de ganglio centinela, algunos de estos casos pueden cambiar y por tanto, una vez se realice la ampliación de márgenes y en su caso el ganglio centinela, algunos de estos datos pueden cambiar y por tanto cambiar la estadificación final del melanoma.
De forma resumida, con la cirugía del melanoma en sí, tendremos la clasificación T (Tabla 1).

¿Es posible que tenga metástasis?¿Qué pruebas se usan para descartarla? Pruebas radiológicas, ampliación de márgenes y ganglio centinela
Antes de proceder a una cirugía definitiva, dependiendo de sobre todo de los factores reflejados en la anatomía patológica, puede ser necesaria la realización de pruebas para descartar metástasis.
No existe un claro consenso en qué pruebas realizar, sobre todo en los casos en los que el melanoma está localizado en la piel y no hay sospecha de que haya metástasis en la exploración física o ante los síntomas que presente el paciente.
En los melanomas que son de mejor pronóstico (índice de Breslow menor de 0.8 mm sin ulceración o en melanoma in situ), si la exploración física es normal y no hay síntomas de sospecha de metástasis, habitualmente no es necesario hacer pruebas complementarias. En este caso, se suele recomendar una ampliación de márgenes (ver Tabla 2) de 0.5-1 cm y seguimiento clínico por su dermatólogo.
La ampliación de márgenes, que de forma ideal se realiza a la vez que el ganglio centinela (si este está indicado), sigue las siguientes recomendaciones (Tabla 2):
| INDICE DE BRESLOW (GROSOR) | MARGEN QUIRÚRGICO RECOMENDADO |
| In situ | 0.5 - 1 cm |
| Menor o igual a 1 mm | 1 cm |
| Mayor de 1 a 2 mm | 1 - 2 cm |
| Mayor de 2 mm | 2 cm |
Tabla 2: recomendaciones de diámetro del margen quirúrgico según sea el grosor del melanoma.
Cuando el melanoma tiene más factores de riesgo que recomiendan la realización de ganglio centinela es cuando habitualmente se hacen otras pruebas complementarias antes.
La mayor parte de guías de sociedades científicas recomiendan ser conservador en la realización de pruebas complementarias en pacientes con melanoma localizado y sin síntomas de sospecha.
Según existan más características de riesgo (por ejemplo, un mayor grosor en el índice de Breslow) o según estén establecidos los protocolos en los distintos hospitales, pueden realizarse alguna de las siguientes pruebas:
-
- Ecografía ganglionar: para descartar que haya ganglios vecinos sospechosos. Si hay sospecha, a veces hay que hacer una punción para su análisis patológico.
- TAC corporal: habitualmente se realiza en casos de melanomas con grosor al menos intermedio-alto (a partir de 2 mm) y ulcerados, ya que en estos hay más riesgo de metástasis.
- PET-TAC: si bien es capaz de detectar metástasis en lugares a los que otras pruebas no llegan, también tiene una mayor probabilidad de detectar lesiones que luego no son malignas y en estos estadios iniciales quizá sea menos eficiente que las otras pruebas.
- Ecografía ganglionar: para descartar que haya ganglios vecinos sospechosos. Si hay sospecha, a veces hay que hacer una punción para su análisis patológico.
Si se ha determinado que no hay sospecha de metástasis ni en los ganglios vecinos ni en otros órganos, y el melanoma tiene una serie de características de riesgo reflejadas en la Tabla 1 (habitualmente melanoma T1b, T2, T3 y T4), seguramente le ofrezcan realizar la técnica del ganglio centinela.
¿Qué es la técnica del ganglio centinela?
Sabemos que si un melanoma produce metástasis fuera de la piel, el sitio más probable por el que empiezan son los ganglios, y el primero en afectarse siguiendo el camino de los vasos linfáticos se llama ganglio centinela. Si somos capaces de analizar ese ganglio, y este es negativo (es decir, no tiene tumor), podemos establecer con un muy alto grado de seguridad que no hay metástasis en los demás ganglios. Si es positivo, pasaríamos al punto 8.
Para determinar el ganglio centinela, su dermatólogo, su cirujano y un especialista en medicina nuclear se coordinarán para realizar una inyección de un compuesto radiactivo (que está perfectamente diseñado para ser seguro) en el lugar donde estaba el melanoma. Este compuesto irá por los vasos linfáticos y asentará en el primer o primeros ganglios que encuentre en su camino, para que en el quirófano, con unos aparatos especiales que miden esa radiactividad, pueda detectarse y así extirpar ese ganglio que será analizado por el patólogo.
A veces, cuando el melanoma está en determinadas localizaciones, como por ejemplo en la mitad espalda, esta sustancia puede seguir varios caminos y “marcar” distintos ganglios centinela, por lo que habrá que hacer extirpaciones de ganglios en distintas zonas del cuerpo. Aunque lo habitual es que sea uno o unos pocos en la misma zona del cuerpo.
Es importante saber que el ganglio centinela se realiza sólo en situaciones en las que no hay sospecha en la exploración física o en las pruebas radiológicas de que los ganglios (u otro órganos) estén afectados.
En caso de que haya una sospecha clara de que haya ganglios que estén afectados (por ejemplo, que se palpen bultos en las zonas en las que están esos ganglios), habitualmente se puede realizar una prueba intermedia, que es una biopsia de dichos ganglios (que puede necesitar la ayuda de una prueba de radiología, como por ejemplo una ecografía).
-
- Si esta es positiva para presencia de melanoma, la técnica del ganglio centinela no se realiza, y se valora dependiendo de las circunstancias de cada paciente y de la presencia o no de metástasis en otros lugares del cuerpo, hacer cirugía consistente en la resección de todos los ganglios del área concreta del cuerpo en donde está ese ganglio (linfadenectomía).
Tengo los resultados del ganglio centinela y éste es negativo. ¿Cuáles son los siguientes pasos?
El patólogo habrá analizado al microscopio su ganglio o ganglios centinela, buscando la presencia de células malignas con distintas técnicas. Si determina que es negativo, no es necesario realizar ninguna intervención más y usted pasará a un seguimiento por parte de su dermatólogo.
Es lo que consideramos en el TNM un N0 (ver más adelante) y por definición su melanoma se clasifica como estadio I o II (ver más adelante), dependiendo de su grosor.
En este seguimiento será fundamental la exploración física, que usted cuente los síntomas que tiene y, dependiendo de determinadas características y de los protocolos de su centro, pueden añadirse otras pruebas complementarias como pruebas de imagen.
Como hemos comentado, la mayoría de guías son conservadoras a la hora de recomendar pruebas de imagen (TAC, PET TAC), si bien en algunos casos puede que se las ofrezcan como parte del seguimiento, especialmente cuando el melanoma tiene factores de riesgo: melanomas de grosor intermedio-alto y/o ulcerados, en concreto T3 y T4.
A día de hoy, no está demostrado que sea útil para el paciente hacer otros tratamientos tras la cirugía en estos casos de estadio IA, IB o IIA. Para pacientes con melanoma estadio IIB y IIC, existe evidencia para la adyuvancia con inmunoterapia, como se explica en el apartado correspondiente.
Tengo los resultados del ganglio centinela y éste es positivo. ¿Cuáles son los siguientes pasos?
Hasta hace pocos años, cuando a un paciente se detectaba en su ganglio centinela afectación por melanoma, se le ofrecía completar la cirugía con la linfadenectomía. Esta intervención consiste en extraer mediante cirugía el resto de ganglios de la zona específica del cuerpo en el que estaba el ganglio centinela (por ejemplo ingle, axila o cuello).
A día de hoy disponemos de mucha información sobre el seguimiento de los pacientes a los que se les ha realizado linfadenectomía y a los que no. Se ha observado que en determinados casos, la ampliación de la cirugía (linfadenectomía) no aporta beneficios adicionales al paciente. Por ello la decisión de ampliar o no la cirugía requiere la valoración pormenorizada de varias circunstancias. Su equipo médico le asesorará sobre los pros y contras de completar la cirugía posterior al ganglio centinela. La decisión no sólo se toma teniendo en cuenta la opinión de los especialistas, sino que el paciente es parte activa de la toma de decisiones una vez ha recibido la información detallada de su caso.
En cualquier caso, si se opta por no hacer esta segunda cirugía (linfadenectomía), debe acompañarse de un seguimiento específico por parte de sus médicos.
Tanto en caso de que se haga linfadenectomía, como si no se realiza, tendremos ya el siguiente paso de la estadificación TNM, en este caso la N. La tabla 3 resume qué significa en el informe de anatomía patológica la letra N.
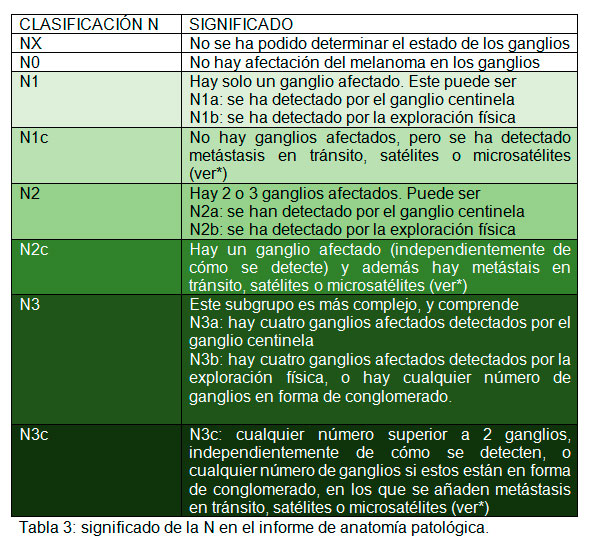
*Las metástasis en tránsito, satélites o microsatélites, son una forma específica de metástasis del melanoma, que suceden cuando afectan a los vasos linfáticos de la piel antes de llegar al ganglio en el que se detendrían primero. Cuando están presentes, le aportan la letra c a la N.
Ya me han operado y no tengo metástasis después de los distintos estudios. ¿Cuál es mi riesgo de recaer?¿Hay alguna forma de evitarlo? Tratamiento adyuvante
El tratamiento adyuvante es aquel tratamiento, ya sea en forma de medicamento (oral, intravenosos o por otra vía), ya sea en forma de radioterapia, que busca evitar la recaída de un tumor una vez eliminado este tumor y una vez se haya demostrado que no hay restos que se puedan ver con el ojo humano o con las distintas técnicas de diagnóstico de imagen (TAC, resonancia, PET TAC, etc).
Por tanto, estamos haciendo un tratamiento para evitar un riesgo de recaída, a diferencia del tratamiento de la enfermedad metastásica, en la que estamos tratando una enfermedad presente.
En los pacientes con melanoma estos tratamientos adyuvantes se valoran en aquellas personas con la enfermedad clasificada como estadio IIB y IIC y para el estadio III (ver Tabla 6).
Medicamentos
En nuestro medio tenemos disponible las siguientes opciones, reflejadas en sus fichas técnicas, y que también se utilizan en las personas a las que han diagnosticado metástasis. En el apartado 10 describimos de forma más detallada los distintos fármacos. Es importante saber, tanto para este contexto adyuvante como en el contexto de enfermedad metastásica, que nos basamos en las fichas técnicas de los mismos. La disponibilidad de financiación de estos tratamientos puede ser distinta según el contexto, por lo que deberá consultar con su oncólogo sobre dicha disponibilidad.
- Inmunoterapia: actualmente cuentan con evidencia para el tratamiento adyuvante de melanoma estadio III los fármacos anti PD-1 nivolumab y pembrolizumab. Pembrolizumab también cuenta con indicación en ficha técnica para el estadio IIB y IIC. Estos son tratamientos intravenosos, que se administran una vez cada 2, 3 o 4 semanas (dependiendo del fármaco y de la dosis que se elija) hasta completar un año, salvo que haya efectos secundarios que impidan continuarlos o haya una recaída de la enfermedad antes de este año. Su uso es independiente del estado de la mutación en BRAF del melanoma.
- Terapia dirigida: en concreto, dabrafenib+trametinib, dos medicaciones que se toman por vía oral, todos los días a una dosis que le explicarán sus médicos, durante un año, salvo que haya efectos secundarios que impidan continuarlos o haya una recaída de la enfermedad antes de este año. Su uso está restringido a pacientes que tienen una mutación en BRAF en su melanoma y en este contexto adyuvante sólo estadio III.
Nadie ha comparado, en el caso de la mutación de BRAF, la inmunoterapia con la terapia dirigida, en este contexto adyuvante por lo que no sabemos a día de hoy cuál es la mejor estrategia. La elección de uno u otro va a depender de disponibilidad de los mismos en cada centro, de sus preferencias personales y de si existen factores que contraindiquen en su caso concreto una u otra opción. Su oncólogo médico le informará sobre los pros y contras de cada opción.
Tampoco nadie ha comparado formalmente en el caso de la inmunoterapia nivolumab con pembrolizumab, por lo que la elección de uno u otro se basará fundamentalmente en el acceso que tenga cada centro a los mismos.
Radioterapia
La radioterapia consiste en sesiones que se administran de forma ambulante, sin precisar ingreso, generalmente una vez al día durante 15-30 minutos (según el grado de complejidad), sin dolor, ni permanencia de la radiación en el cuerpo, por lo que no hay que tener precauciones con niños o mujeres embarazadas. El número de sesiones es muy variable según el objetivo del tratamiento, oscilando desde una sola sesión, hasta un máximo de 30-35 sesiones.
La radioterapia raramente se administra localmente, salvo en el lentigo maligno, melanoma ocular y en los melanomas de mucosas.
Sus indicaciones más frecuentes son tras la cirugía de los ganglios y en el caso de aparición de metástasis tanto para aliviar algún síntoma (tratamiento paliativo), como para erradicar algún foco que se escapa del control de los fármacos.
La irradiación ganglionar después de la operación:
- No aumenta la supervivencia de los pacientes: es decir, los pacientes que hacen radioterapia después de la cirugía viven lo mismo que a los que no se les realiza.
- No disminuye el riesgo de metástasis en otros órganos.
- Sí que disminuye el riesgo de que haya recaída ganglionar en un 15%.
Me han diagnosticado de metástasis de melanoma. ¿Cuáles son los tratamientos que puedo recibir? Inmunoterapia, terapia dirigida y ensayos clínicos. Papel de la radioterapia. Situaciones especiales: metástasis cerebrales
Ya sea durante el seguimiento clínico o con pruebas radiológicas, o ya sea en el diagnóstico inicial (también clínico y con pruebas radiológicas), se puede dar el caso de que se diagnostiquen metástasis, es decir, aparición de lesiones en zonas u órganos del cuerpo a distancia de donde estaba el melanoma originalmente. También puede darse la circunstancia de que el melanoma se presente o recaiga en la misma zona donde se diagnostica pero este sea imposible de extirpar (es lo que llamamos melanoma localmente avanzado irresecable).
El tratamiento fundamental en estos casos va a ser el tratamiento con medicamentos oncológicos, aunque es importante saber que tanto la cirugía, como la radioterapia, pueden aportar valor al tratamiento global del paciente con melanoma irresecable o metastásico.
Estos tratamientos quirúrgicos y/o radioterápicos se utilizan tanto para mejorar la calidad de vida y síntomas que pueda ocasionar el melanoma, como para incluso en algunos casos muy seleccionados, con metástasis pequeñas, accesibles y sobre todo si son únicas (lo que denominamos melanoma oligometastásico) hacer un tratamiento “radical”, es decir, con intención de eliminar la enfermedad. En todos estos casos sus médicos se coordinarán para establecer si esta es una opción para usted.
Por otro lado, y siendo estos los casos más frecuentes, cuando el melanoma produce metástasis que son múltiples, o en múltiples órganos, o en caso en los que siendo únicas no es posible la resección y/o tratamiento con radioterapia, es necesario realizar tratamiento con medicamentos. Por suerte, ha habido avances en los últimos años a este respecto que hacen que el pronóstico de los pacientes haya mejorado sustancialmente.
De nuevo, es importante saber que para los tratamientos descritos nos basamos en las fichas técnicas de los mismos. La disponibilidad de financiación de estos tratamientos, independientemente de estar reflejados en ficha técnica, puede ser distinta según el contexto, por lo que deberá consultar con su oncólogo sobre dicha disponibilidad.
La tercera letra del TNM, la M, sirve para clasificar las metástasis del melanoma (tabla 4), y puede tener implicaciones a la hora de realizar tratamientos, especialmente en los casos de metástasis cerebrales.
Su médico le hará una serie de pruebas, entre las que se encuentran pruebas radiológicas (TAC de cuerpo entero incluyendo TAC cerebral y/o resonancia cerebral, o bien PET-TAC), así como una analítica completa de sangre que incluya un parámetro que se llama LDH.
La LDH es importante, ya que cuanto más elevado esté, nos indica que puede haber un peor pronóstico y establece una clasificación propia dentro de la letra M (0 si es normal, 1 si está elevada).

Antes de decidir el tratamiento médico para su caso, es importante conocer el estado de la mutación de BRAF de su melanoma. De forma general, un 50% (uno de cada dos) melanomas tienen una mutación en este gen BRAF. Esta mutación es del melanoma y no del paciente, por lo que su presencia o ausencia no tiene que ver con un mayor o menor riesgo en la familia (ver punto 3).
Sabemos que los pacientes con melanoma metastásico y mutación en BRAF (y con melanoma estadio III extirpado, ver punto 9) se benefician del tratamiento con terapia dirigida. Estos tratamientos de terapia dirigida no sirven para los pacientes con melanoma BRAF no mutado.
La terapia dirigida se basa en medicaciones orales (píldoras o comprimidos, según el medicamento) que bloquean específicamente a BRAF cuando está mutado, y a una proteína relacionada con BRAF que se llama MEK. Cuando se bloquean ambas (cada una con un fármaco específico), el melanoma reduce su tamaño en la mayoría de sus casos y el paciente tiene mejores expectativas de supervivencia que si no se hiciera, o si sólo se bloqueara una de ellas. Por eso utilizamos dos fármacos distintos.
Estos fármacos se toman todos los días (con la excepción del cobimetinib, que se toma 21 días seguidos, para descansar una semana y retomarlo después) en distintas dosis según qué tipo se prescriba.
Son fármacos que se pueden tomar en casa pero que se dispensan en las farmacias de los hospitales. Actualmente tenemos tres opciones disponibles, cada una con sus dosis y calendarios de administración (Tabla 5).
Nadie ha comparado las distintas opciones de terapia dirigida entre ellas, y en términos de eficacia son equivalentes si comparamos los resultados de los distintos estudios, con algunas diferencias en algunos efectos adversos, por lo que la elección de la misma dependerá fundamentalmente de la disponibilidad de los mismos en cada centro.
Dependiendo de los efectos secundarios que puedan aparecer, a veces es necesario suspender o reducir las dosis.
Su oncólogo médico y también en muchos centros su enfermera y su farmacéutico hospitalario le informarán sobre la forma de tomar esta medicación, los eventos adversos más frecuentes y qué hacer ante la aparición de los mismos.
Estos tratamientos deben mantenerse de forma indefinida, a no ser que existan efectos adversos que no se puedan tolerar, o que suceda una recaída del melanoma.

Inmunoterapia
La inmunoterapia son tratamientos que se administran por vía intravenosa. Son anticuerpos que no atacan al melanoma, sino que desbloquean a las células de nuestra sistema inmune (en concreto a unas células llamadas linfocitos) para que sean ellas las que destruyan a las células malignas.
Estos tratamientos sirven tanto para pacientes que no tienen en su melanoma la mutación de BRAF, como para los que sí que tienen la mutación de BRAF.
Para los pacientes que no tienen la mutación en BRAF en su melanoma, son la primera opción salvo que exista una contraindicación muy clara.
Para los pacientes que tienen la mutación en BRAF en su melanoma, nadie ha comparado por qué tratamiento es mejor empezar, si por la inmunoterapia o si por la terapia dirigida (ver apartado anterior), por lo que la elección de uno u otro en el caso de melanoma con mutación en BRAF va a depender de sus preferencias, de la experiencia del centro y de si existen algunas características en usted que contraindiquen de inicio una u otra opción. Su oncólogo médico le asesorará sobre los pros y contras de cada opción.
Actualmente existen cinco tratamientos registrados en ficha técnica en nuestro medio europeo que se incluyen en la inmunoterapia, y son:
-
- Pembrolizumab: se usa cada 3 o cada 6 semanas, dependiendo de la dosis que se elija o esté disponible.
- Nivolumab: se usa cada 2 o 4 semanas, dependiendo de la dosis que se elija o esté disponible.
Nadie ha comparado nivolumab con pembrolizumab, y los resultados de los distintos estudios, si se comparan indirectamente, podemos decir que son equivalentes en eficacia y muy similares en efectos adversos. La elección de uno u otro va a depender fundamentalmente de la disponibilidad de cada centro.
Con respecto a la toxicidad, estos fármacos tienen la peculiaridad de que, al activar nuestras propias defensas, estas pueden producir lo que se llama efectos autoinmunes, que pueden suceder en cualquier momento del tratamiento y en cualquier órgano. Su oncólogo médico así como en muchos centros su enfermera le explicarán en qué consisten estos efectos secundarios, la forma de detectarlos y estará disponible para detectarlos a tiempo y establecer los tratamientos o la necesidad de ayuda de otros especialistas que sean necesarios para revertir estos efectos indeseados.
Al igual que la terapia dirigida, de forma teórica estos tratamientos de inmunoterapia han de mantenerse formalmente de forma indefinida hasta que aparezcan efectos secundarios que impidan mantenerlos, o bien hasta llegado el caso de que la enfermedad empeore. Hay, no obstante una serie de peculiaridades que tiene la inmunoterapia y que su oncólogo médico seguramente discuta con usted:
-
- Llegado el caso de que se tenga que suspender por aparición de efectos secundarios graves (por suerte muy infrecuentes, pero posibles), un número significativo de pacientes pueden haber alcanzado un beneficio que se mantiene en el tiempo incluso cuando haya sido necesario tratar con inmunosupresores. Es decir, que se puede optar tras suspender el tratamiento siempre que la enfermedad esté controlada por seguimiento, y no añadir tratamientos distintos hasta que la enfermedad reaparezca o empeore.
- En pacientes en los que ha habido una muy buena respuesta a la inmunoterapia, particularmente en los que haya desaparecido la enfermedad o en aquellos que los que se haya reducido de forma significativa, se puede valorar con su oncólogo la posibilidad de parar el tratamiento una vez se lleven dos años o más de tratamiento, ya que tenemos evidencia de al menos dos ensayos y algunos estudios retrospectivos de que ese beneficio se puede mantener sin tratamiento de forma prolongada, pudiendo reservar la reintroducción de la inmunoterapia en caso de reaparición o empeoramiento de la enfermedad.
- En ocasiones al inicio del tratamiento, puede haber un empeoramiento de la enfermedad. Al igual que con otros tratamientos, estos significa en la mayoría de ocasiones que no está funcionando, pero en un porcentaje pequeño de pacientes (entre un 4 y 10% según los estudios), manteniendo el tratamiento la enfermedad puede mejorar. Es lo que conocemos como “pseudoprogresión”. La decisión de mantener el tratamiento tras un empeoramiento inicial es una decisión compleja y que debe tomarse valorando pros y contras entre usted y su oncólogo, siendo necesario establecer para ello:
- Cuál es su estado de salud actual.
- Si existen otras alternativas a la inmunoterapia.
- Un seguimiento muy estrecho en caso de continuar para confirmar realmente cómo está yendo la enfermedad.
-
- Nivolumab en combinación con ipilimumab: esta combinación está reflejada en ficha técnica, si bien en nuestro entorno su recomendación más formal está restringida a tres indicaciones:
- Melanoma uveal con metástasis: es un tipo de melanoma cuyo origen está en las capas internas del ojo (coroides) o en la zona que le da color (iris) y que aparentemente responde mejor a esta combinación que a los dos fármacos si se dan por separado.
- Melanoma con metástasis cerebrales que no presentan síntomas neurológicos y que no precisan corticoides: en este caso parece que el beneficio pudiera ser mayor que con los dos fármacos por separado.
- Melanoma metastásico con baja expresión (menor o igual a 1%) de un marcador en el tumor llamado PD-L1
Esta combinación parece que es más activa en pacientes con melanoma de forma general (además de las indicaciones arriba expresadas de metástasis cerebrales y melanoma uveal), si bien el estudio en el que se evaluó presenta dificultades a la hora de interpretar claramente si es mejor dar esta combinación o dar un fármaco anti PD-1 (nivolumab o pembrolizumab) solo. Además, sabemos que la probabilidad de desarrollar toxicidad inmune es mayor con la combinación que con nivolumab o pembrolizumab en monoterapia.
Por todo ello, la elección de la combinación más allá de los usos arriba referidos (indicaciones más formales) debe tener en cuenta los pros y contras de forma cuidadosa entre usted y su oncólogo.
- Nivolumab en combinación con relatlimab: esta combinación ha demostrado, de forma independiente a BRAF, ser superior a nivolumab en el tiempo que mantiene bajo control la enfermedad metastásica (lo que llamamos en oncología supervivencia libre de progresión), aunque no ha demostrado aún que los pacientes vivan más. En nuestro medio europeo, el tratamiento está indicado en pacientes con melanoma metastásico con baja expresión (menor a 1%) de un marcador en el tumor llamado PD-L1.
- Tebentafusp: es un fármaco que, si bien está encuadrado en la inmunoterapia, tiene una serie de peculiaridades. De momento sólo cuenta con aprobación en Europa para pacientes con melanoma uveal metastásico (al igual que nivolumab más ipilimumab en nuestro medio español); y precisa que el paciente tenga un subtipo inmunológico específico llamado (HLA)-A*02:01, que se analiza mediante una analítica de sangre especial.
La radioterapia para pacientes con melanoma y presencia de metástasis
Además de lo comentado en el punto 10, las nuevas tecnologías, como la SBRT (radioterapia de alta dosis en pocas sesiones), permiten realizar tratamientos muy sofisticados con pocas complicaciones teniendo un importante papel en el control de las metástasis, sobre todo cerebrales.
La asociación con los fármacos puede potenciar el efecto beneficioso de los mismos. En concreto con la inmunoterapia, se ha descrito un efecto positivo de la asociación que consiste en que al administrar radioterapia en un foco tumoral pueden responder otros lesiones alejadas del campo de irradiación (efecto abscopal); esto se debe a la potenciación del sistema inmunitario.
Por otro lado, estas combinaciones pueden potenciar también la toxicidad, por lo que es importante valorar el balance de beneficio y riesgo en comités multidisciplinares.
La radioterapia puede aportar beneficio en la enfermedad metastásica tanto para aliviar los síntomas (paliativa) como para acabar con pequeños focos tumorales (radical), siendo de especial interés su papel en las localizaciones cerebrales.
Ensayos clínicos
Es posible que, en cualquiera de las etapas de diagnóstico y tratamiento de su melanoma, le ofrezcan participar en algún ensayo clínico o que usted quiera participar o informarse sobre alguno de los ensayos disponibles.
En melanoma, por suerte, se ha avanzado mucho en los últimos años, y de ahí las distintas opciones que aparecen en este documento (que han sido posibles precisamente gracias a la participación de pacientes en ensayos). Sin embargo no tenemos aún todas las respuestas en todas las situaciones y es por ello que existen los ensayos clínicos.
Los ensayos clínicos buscan dar respuesta a problemas de salud en los que vemos que o bien no hay una solución adecuada, o existen distintas soluciones pero queremos saber cuál es mejor, o queremos analizar si podemos mejorar las opciones que se ofrecen de forma estándar.
La participación en los ensayos clínicos es siempre voluntaria y debe asegurar, tanto si se quiere o se puede participar en ellos, como si no, que el tratamiento considerado en ese momento como estándar esté garantizado.
Existen en España múltiples ensayos clínicos en marcha para distintas situaciones. Si usted está interesado, pregunte a su equipo médico o consulte en las páginas de las distintas sociedades científicas o asociaciones de pacientes (varias disponibles en la sección de enlaces de interés).
Clasificación TNM del melanoma

Enlaces de interés
http://www.gepac.es/ - Página web del grupo de pacientes con cáncer en España
https://www.aecc.es/ - Página web de la asociación española contra el cáncer
https://www.groupgem.es/ - Página web del Grupo Español de Melanoma
https://aedv.es/ - Página web de la Academia Española de Dermatología y Venereología
https://reec.aemps.es/reec/public/web.html - Página web estatal en la que se puede consultar dónde hay ensayos clínicos (para cualquier tumor)




