Cáncer de mama
Índice de navegación
- Cáncer de mama
- Definición
- Epidemiología y factores de riesgo
- Cáncer de mama hereditario
- Detección precoz y cribado
- Síntomas
- Diagnóstico
- Anatomía patológica
- Clasificación molecular del cáncer de mama
- Estadificación
- Factores pronósticos y predictivos
- Modalidades de tratamiento
- Tratamientos según el estadio
- Seguimiento del cáncer de mama
- Todas las páginas
AUTORA: Dra. Ana Santaballa Bertrán
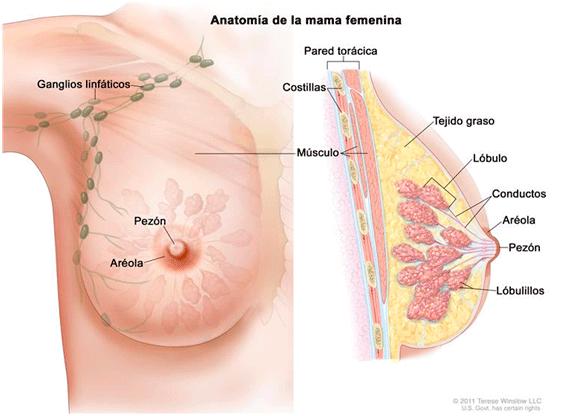
La mama está formada por 10 o 20 secciones llamados lóbulos. Cada lóbulo está dividido en secciones más pequeñas llamadas lobulillos. Los lobulillos contienen las glándulas encargadas de producir la leche durante la lactancia. La leche fluye del lobulillo al pezón por unos tubos llamados ductos. El espacio entre las lobulillos y los ductos está lleno de grasa y tejido fibroso.
Además, las mamas tienen vasos linfáticos que van a unos órganos pequeños redondos, los ganglios linfáticos, que tienen como función la protección, atrapan bacterias, células tumorales y otras sustancias nocivas (los vasos y ganglios linfáticos están presentes por todo el cuerpo).
El drenaje linfático de las mamas se produce fundamentalmente a los ganglios linfáticos axilares.
Definición
El cáncer de mama consiste en la proliferación acelerada e incontrolada de células del epitelio glandular. Son células que han aumentado enormemente su capacidad reproductiva.
Las células del cáncer de mama pueden diseminarse a través de las sangre o de los vasos linfáticos y llegar a otras partes del cuerpo. Allí pueden adherirse a los tejidos y crecer formando metástasis.
El cáncer de mama puede aparecer en mujeres y hombre pero más del 99% de los casos ocurre en mujeres.
Epidemiología y factores de riesgo
El cáncer de mama es el cáncer más frecuente en la mujer española. La estimación de nuevos casos de cáncer de mama en España para 2022 es de 34750. Se calcula que 1 de cada 8 mujeres españolas tendrá un cáncer de mama en algún momento de su vida.
Aunque la mortalidad por cáncer de mama ha descendido en los últimos años gracias a los programas de cribado y a la mejora de los tratamientos el cáncer de mama sigue siendo la primera causa de muerte por cáncer en España en las mujeres. En 2020 fallecieron 6572 mujeres por cáncer de mama en España.
La edad de máxima incidencia está por encima de los 50 años, pero aproximadamente un 10% se diagnostica en mujeres menores de 40 años.
El estadio en el que se ha diagnosticado el cáncer influye en la supervivencia. La supervivencia en el estadio I es de más del 98% y en cambio en los estadios IV la supervivencia desciende al 24%.
La causa o causas que producen un cáncer de mama todavía no están aclaradas, sin embargo sí se han identificado numerosos factores de riesgo asociados al cáncer de mama. La mayor parte de los ellos se relaciona con los antecedentes reproductivos que modulan la exposición hormonal durante la vida.
Los factores de riesgo para padecer un cáncer de mama son:
- La edad es el principal factor de riesgo para padecer un cáncer de mama. El riesgo aumenta al aumentar la edad.
- Historia personal de cáncer de mama invasivo (las mujeres que han tenido un cáncer de mama invasivo tienen más riesgo de padecer un cáncer de mama contralateral), carcinoma ductal in situ o carcinoma lobulillar in situ.
- Historia de hiperplasia atípica.
- Densidad mamaria elevada en las mamografías.
- Factores reproductivos que aumentan la exposición a los estrógenos endógenos, como la aparición temprana de la primera regla, la menopausia tardía o la nuliparidad (no haber estado embarazada nunca).
- El uso de terapia hormonal sustitutiva después de la menopausia aumenta el riesgo de cáncer de mama, al igual que lo hace el uso de una combinación de las hormonas estrógeno y progesterona posterior a la menopausia .
- La exposición a radiaciones ionizantes, sobre todo durante la pubertad, y las mutaciones hereditarias relacionadas con el cáncer de mama, aumentan el riesgo.
- El consumo de alcohol.
- La obesidad.
- Predisposición genética (antecedentes familiares o mutaciones en determinados genes)
Cáncer de mama hereditario
El cáncer hereditario es aquel que tiene su origen en alguna mutación genética.
Se estima que el 5-10% de los cánceres de mama son hereditarios. El 20-25% de las mutaciones responsables de los cánceres de mama hereditarios ocurren en los genes BRCA 1 y 2. La probabilidad de que una mujer portadora de mutación en los genes BRCA 1 o 2 presente cáncer de mama se sitúa en torno al 57% a los 70 años. Existen otros genes como PALB2, p53, CDH1, ATM, CHEK2 o BRIP1 que también aumentan la probabilidad de padecer un cáncer de mama a lo largo de la vida.
El análisis genético de BRCA1 y BRCA2 es complejo y caro, por ello es necesario realizar una selección muy precisa de aquellas familias que se pueden considerar de alto riesgo y en las que esté indicado el estudio genético.

Le recomendamos que contacte con su Oncólogo médico o Unidad de Consejo Genético en caso de cumplir con alguno de los criterios anteriores.
Detección precoz y cribado
El cáncer de mama constituye un importante problema de salud en España, tanto por su elevada incidencia y mortalidad como por sus repercusiones físicas, psicológicas y económicas en la población. A pesar de los avances diagnósticos y terapéuticos, su pronóstico sigue dependiendo principalmente de la extensión de la enfermedad en el momento de la detección. De ahí que el conseguir un diagnóstico precoz siga siendo la mejor vía para mejorar sus posibilidades de curación.
La mamografía se ha acreditado como la prueba de cribado más efectiva para mujeres con un riesgo promedio. Los programas de cribado mediante mamografía consiguen una disminución en la mortalidad por cáncer de mama. Actualmente todas las Comunidades Autónomas españolas poseen programas de cribado poblacional de cáncer de mama.
En las mujeres de alto riesgo las recomendaciones son distintas en cuanto al inicio, la frecuencia de las exploraciones y las exploraciones indicadas (ver información en web SEOM.)
Síntomas
Un nódulo palpable en la mama es el signo más frecuente por el que se consulta, generalmente no doloroso, aunque también es frecuente la retracción del pezón o alteraciones de la piel de la mama.
Si notase alguno de estos síntomas, debe consultar con su ginecólogo o cirujano para que lo valore e inicie un estudio más profundo si lo considera apropiado.
Diagnóstico
Cuando existe una sospecha de cáncer de mama bien por la exploración física (tanto por la paciente como por un médico) o bien por una mamografía de rutina, se inicia un estudio para confirmar o descartar esa sospecha. Las pruebas de imagen orientaran sobre el diagnóstico pero el diagnóstico de certeza de cáncer de mama requiere siempre una confirmación con biopsia.
Pruebas de imagen que estudian la mama:
Mamografías: son imágenes de rayos X que detectan zonas anómalas en la mama. No tienen un 100% de fiabilidad por lo que pueden dar imágenes sospechosas que finalmente no sean malignas (falsos positivos) o dejar de diagnosticar algún tumor maligno (falsos negativos).
Ecografía: técnica que utiliza los ultrasonidos para producir una imagen y que puede distinguir lesiones quísticas (rellenas de líquido, normalmente no tumorales) de lesiones sólidas (más sospechosas). Muchas veces esta técnica complementa a la mamografía. La ecografía también puede valorar el estado de los ganglios de la axila que son el primer sitio de diseminación del cáncer de mama.
Resonancia magnética nuclear (RMN): es una exploración radiológica que utiliza la acción de un campo electromagnético para la obtención de imágenes. Puede ser necesaria en mujeres con tejido mamario denso, mujeres con mutación del gen BRCA o mujeres portadoras de prótesis de silicona.
Si se sospecha un cáncer de mama el siguiente paso es tomar una muestra de tejido del mismo para analizarlo.
Biopsia: consiste en la extracción de una muestra del tejido de la zona sospechosa para analizarlo en el microscópico y poder determinar las características benignas o malignas del mismo, así como el tipo de células tumorales, el grado de agresividad de las mismas y algún otro parámetro de interés a la hora de tomar decisiones sobre el tratamiento.
La biopsia puede hacerse por palpación directa o guiada por ecografía, esto puede hacerse con una aguja fina (PAAF) o con aguja gruesa (BAG) para obtener mayor cantidad de tejido. En ocasiones, puede ser necesaria una biopsia en el quirófano.
A veces, cuando la zona sospechosa sólo se ve en pruebas de imagen (y no hay alteraciones en la exploración física), se marca la zona sospechosa con una aguja guiada por alguna técnica de imagen para que pueda ser identificada después por el cirujano.
Pruebas que valorarán si existe diseminación de la enfermedad a otros órganos
Tras la confirmación del diagnóstico de cáncer de mama con biopsia se realizan otras pruebas radiológicas para asegurarse que no existen metástasis en otros órganos. Estas exploraciones suelen recomendarse para estadios II o superiores. En las pacientes con tumores pequeños y ganglios negativos (estadio I) estos estudios no son necesarios.
Radiografía de tórax: normalmente se realiza antes de la cirugía y sirve para descartar afectación pulmonar por el tumor.
Ecografía abdominal: imagen del abdomen, conseguida utilizando ultrasonidos. Se utiliza para valorar el hígado y resto de estructuras abdominales.
Gammagrafía ósea: es un examen que detecta áreas de aumento o disminución en el metabolismo de los huesos y se utiliza entre otras cosas para valorar si el tumor se ha extendido a los huesos.
Tomografía axial computerizada (TAC): Es otra técnica radiológica que sirve para descartar afectación a distancia de la mama (ganglios, hígado, pulmones, hueso).
Tomografia por emisión de positrones (PET): Podría utilizarse como alternativa a la gammagrafía ósea o al TAC para valorar la extensión de la enfermedad.
Anatomía patológica
El diagnóstico definitivo de cáncer de mama lo establece el especialista en anatomía patológica al observar células malignas bajo el microscopio a partir de la muestra de la biopsia.
El examen patológico clasificará el cáncer como invasivo o no invasivo. Los cánceres no invasivos también se denominan in situ y son áquellos que no se han extendido fuera del conducto (ductales in situ) o del lobulillo (lobulillares in situ).
El patólogo analiza varios aspectos de la pieza que recibe y así define el tumor y establece algunos factores importantes para determinar el pronóstico y la respuesta a determinados tratamientos:
Tamaño tumoral: cuanto mayor sea el tumor más riesgo tiene de recidiva.
Tipo histológico: depende de las células de las que derive el tumor. El carcinoma ductal es el tipo más frecuente (80%) y deriva de los conductos por donde fluye la leche, el siguiente en frecuencia es el carcinoma lobulillar que deriva de las células del lóbulo (donde se produce la leche).
Grado histológico: describe el grado de diferenciación (maduración) de las células del tumor. Las que son más diferenciadas (grado I), son más maduras y menos agresivas en oposición a las menos diferenciadas (grado III).
Afectación ganglionar: el número de ganglios afectados es el factor pronóstico más importante de forma que cuanto mayor es el número de ganglios afectos, mayor es el riesgo de recaída. Por ello, cuando se opera un cáncer de mama es fundamental el análisis de los ganglios linfáticos de la axila puesto que se considera el primer sitio de extensión del tumor.
Una opción para evaluar los ganglios es la técnica del ganglio centinela (ver en sección de tratamiento) que permite conservar la mayoría de los ganglios axilares para evitar complicaciones secundarias debidas a la extirpación de toda la cadena ganglionar.
Receptores hormonales: el patólogo analiza si las células del tumor presentan receptores para dos tipos de hormonas, los estrógenos y la progesterona. Esto tiene su interés por que su expresión confiere mejor pronóstico y porque indican que las pacientes que los tienen van a responder a la terapia hormonal.
HER-2 (receptor 2 del factor de crecimiento epidérmico humano): es una proteína que participa en el crecimiento de las células. Está presente en células normales y en la mayoría de los tumores, pero en un 15-20% de los tumores de mama se encuentra en concentraciones elevadas y esto confiere al tumor mayor agresividad. Estos tumores con sobreexpresión de HER-2 son con mucha frecuencia sensibles al tratamiento con tratamientos anti-HER 2.
Ki 67: KI 67 es una proteína que se halla en el núcleo de las células cuando se dividen. KI 67 determina el índice de proliferación. Los tumores con índices de proliferación altos (>14%) tiene peor pronóstico.
Plataformas moleculares o perfiles de expresión génica: En la biopsia puede cuantificarse la expresión de diversos genes expresados por el tumor. Estas plataformas pueden ayudar a predecir el riesgo de recaída y el beneficio de la quimioterapia adyuvante en los tumores luminales. En la actualidad existen varias plataformas comercializadas.
El patólogo también informara del estado de los márgenes tras la cirugía para saber si el tumor se ha extirpado por completo. Si los márgenes son positivos quiere decir que no se ha extirpado todo el tumor en su totalidad y es posible que tenga que realizarse una nueva cirugía.
Clasificación molecular del cáncer de mama
Con el desarrollo de técnicas más sofisticadas se puede analizar los genes de cada cáncer de mama. Estas técnicas han dado lugar a una clasificación más precisa del cáncer de mama que se correlaciona mejor con el riesgo de recaída de la enfermedad. La clasificación molecular establece cuatro tipos de cáncer de mama: Luminal A, luminal B (puede ser HER2 negativo o HER 2 positivo), HER 2 y basal like. Los tumores luminales tiene receptores hormonales positivos, los HER2 expresión de HER2 y los basal like o triple negativos no expresan ni receptores hormonales ni HER2. El subtipo Luminal A es el de mejor pronóstico y el basal like el de peor pronóstico.

Estadificación
Como en el resto de tumores, todos los subtipos de cáncer de mama se clasifican en estadios según la extensión de la enfermedad. Un cáncer de mama en estadio I es un cáncer de mama en una etapa inicial y un estadio IV es un cáncer de mama avanzado que se ha extendido a otras partes del cuerpo.
El sistema de clasificación TNM se basa en el tamaño del tumor (T) y su extensión a los ganglios linfáticos regionales (N) o a otras partes del cuerpo (M). El estadio, por lo general, no se conoce hasta después de la cirugía en la que se extirpa el tumor y se analiza el estado de los ganglios axilares.

Cáncer inflamatorio de mama: El tumor se ha diseminado hasta la piel de la mama que aparece enrojecida, hinchada y caliente. Esto se produce porque las células tumorales bloquean los vasos linfáticos de la piel. A veces puede tener una apariencia de hoyos que se compara con la “piel de naranja”. Puede estar en estadio IIIB, IIIC o IV.
Factores pronósticos y predictivos
Un factor pronóstico es cualquier medida disponible en el momento de la cirugía o del diagnóstico que se correlaciona con la evolución de la enfermedad en ausencia de tratamiento adyuvante sistémico. Los factores pronóstico seleccionan a las pacientes que pueden beneficiarse de un tratamiento adyuvante.
Un factor predictivo es cualquier medida que predice la respuesta a un tratamiento específico. Los factores predictivos pueden identificar el mejor tratamiento para una paciente concreta.
Hay factores que pueden ser pronóstico y predictivos a la vez.
Los principales factores pronóstico en el cáncer de mama los obtenemos de la biopsia, pero hay algunos que dependen de la propia paciente como la edad y el estado menopáusico. Las pacientes jóvenes tienen más riesgo que las pacientes mayores. El resto de factores son:
- Tamaño tumoral. El riesgo de recaída es más alto cuanto más grande es el tumor.
- Afectación de los ganglios axilares. El número de ganglios afectados es el factor pronóstico más importante de forma que cuanto mayor es el número de ganglios afectos, mayor es el riesgo de tener una recaída.
- Grado de diferenciación celular. Cuanto menos diferenciado es el tumor tiene peor pronóstico.
- Expresión de receptores hormonales. La expresión de receptores hormonales es un factor de buen pronóstico y a la vez es un factor que predice la respuesta al tratamiento hormonal.
- Expresión o amplificación de HER2. Es un factor de mal pronóstico pero predice la respuesta a tratamientos dirigidos contra HER2 como trastuzumab. La utilización de tratamiento anti-HER2 ha revertido el mal pronóstico de estos tumores.
- Subtipo de cáncer de mama. El subtipo luminal A es el de mejor pronóstico y el triple negativo el de peor pronóstico.
Modalidades de tratamiento
El tratamiento del cáncer de mama debe individualizarse y se basa en múltiples factores. El tratamiento óptimo requiere de la colaboración de un equipo multidisciplinar: cirujanos, oncólogos médicos y oncólogos radioterapeutas.
Clásicamente en los estadios iniciales el tratamiento del cáncer de mama se iniciaba con la cirugía y posteriormente se administraba el tratamiento sistémico y la radioterapia (tratamiento adyuvante). En la actualidad, se puede ofrecer previamente a la cirugía y la radioterapia tratamiento sistémico (tratamiento neoadyuvante). Esta estrategia puede facilitar una cirugía conservadora en algunos casos en que esta no es posible de entrada, así como proporcionar información sobre la respuesta “in vivo” del tumor para individualizar el tratamiento posterior en función de dicha respuesta.
En los estadios avanzados, el tratamiento principal será sistémico, aunque puede emplearse la cirugía o la radioterapia en situaciones concretas.
Cirugía
El objetivo de la cirugía es extirpar el tumor y analizar los ganglios de la axila.
Existen dos opciones de cirugía en las mujeres con un cáncer de mama localizado:
- Cirugía conservadora. Se extirpa el tumor con una pequeña cantidad de tejido sano alrededor. Con esta cirugía se conserva la mama, pero en general se debe administrar radioterapia después con objeto de eliminar las células tumorales que pudieran quedar tras la cirugía en la mama.
La posibilidad de realizar una cirugía conservadora depende de varios factores como la localización del tumor, el tamaño del tumor y de la mama o los deseos de la paciente. - Mastectomía. En esta cirugía se extirpa toda la mama. Las pacientes que se someten a una mastectomía pueden reconstruirse la mama. La reconstrucción puede hacerse en el momento de la mastectomía (reconstrucción inmediata) o después de finalizar todos los tratamientos (reconstrucción diferida). Para decidir el momento ideal de la reconstrucción deben valorarse muchos factores relacionados con el tratamiento (si va a recibir radioterapia, que tipo de reconstrucción se va a hacer) y por supuesto de las preferencias de la paciente. La reconstrucción puede realizarse con tejido propio de la paciente o mediante el uso de implantes.
La elección del momento de la reconstrucción y el tipo de reconstrucción deberá discutirla con el equipo que la atiende.
Uno de los primeros sitios donde se disemina el cáncer de mama son los ganglios de la axila. La afectación de los ganglios de la axila es el principal factor pronóstico en el cáncer de mama, como hemos comentado previamente.
La única forma de saber si el cáncer se ha extendido a la axila es examinar los ganglios en el microscopio, por ello durante la cirugía es necesario extirpara algunos ganglios linfáticos para ser analizados. Esto se conoce como linfadenectomía. La linfadenectomía debe hacerse siempre que los ganglios están aumentados de tamaño o cuando el tumor de la mama es grande.
La linfadenectomía produce efectos secundarios como: adormecimiento temporal o permanente de la cara interna del brazo, limitación temporal de los movimientos del brazo y del hombro o hinchazón del brazo (linfedema).
En los casos en que los ganglios no encontramos ganglios aumentados de tamaño durante el estudio por imagen puede realizarse la técnica de ganglio centinela. La ventaja principal de la técnica del ganglio centinela es evitar los efectos secundarios de la linfadenectomía, sobre todo el linfedema.
Biopsia del ganglio centinela
El ganglio centinela es el primer ganglio que recibe el drenaje linfático del tumor y por tanto, es el primer ganglio linfático donde es posible que el tumor se disemine.
Se localiza inyectando una sustancia radioactiva o un tinte azul cerca del tumor. Esta sustancia fluye a través de los conductos linfáticos hasta los ganglios linfáticos.
El procedimiento consiste en extraer el primer ganglio linfático que recibe esta sustancia y analizar si está afectado por el tumor. Si no se detectan células tumorales, no hará falta extraer más ganglios y así se evita la linfadenectomía y sus posibles complicaciones. En el caso de que exista afectación del ganglio centinela por el tumor, debe hacerse la linfadenectomía (a veces en el mismo acto quirúrgico y otras en un segundo tiempo).
La realización de la biopsia de ganglio centinela requiere de un equipo multidisciplinar (cirujanos, médicos nucleares, patólogos) entrenados en la técnica.
La técnica del ganglio centinela no está indicada en todas las situaciones (tumores multicéntricos o grandes, pacientes con intervenciones previas en la mama o axila o en mujeres embarazas). Su cirujano le informara sobre la técnica y su indicación o no en su caso.
Radioterapia
Se basa en el uso de rayos X de alta energía u otros tipos de radiación para destruir células tumorales o impedir que crezcan.
1.- Como tratamiento adyuvante
Se utiliza como complemento a la terapia local (adyuvante) para eliminar las posibles células tumorales que hayan podido quedar tras la cirugía. Tras una mastectomía hay casos en los que también está indicada con el mismo fin, o tras la linfadenectomía para completar el tratamiento de la axila cuando hay un cierto número de ganglios aislados afectados por el tumor.
2.- Como tratamiento paliativo
Se utiliza para aliviar síntomas como el que dolor que produce la afectación ósea o ganglionar o aliviar la presión en el cráneo producida una metástasis cerebral.
Tipos de radioterapia:
Radioterapia externa. Una máquina fuera del cuerpo envía radiación al área donde está el tumor.
Radioterapia interna o braquiterapia.Se usa una sustancia radiactiva sellada en agujas, alambres o catéteres que se colocan en la zona tumoral.
Los efectos secundarios más frecuentes de la radioterapia sobre la mama son el hinchazón local, alteraciones de la piel tipo quemadura y cansancio. Estos efectos desaparecen en unos meses. Algunas veces hay una disminución del tamaño de la mama y se muestra más firme.
Radioterapia intraoperatoria. Es áquella que se realiza en el mismo quirófano tras extirpar el tumor. Tiene la ventaja sobre las otras formas de administración que acorta la duración del tratamiento y reduce la toxicidad.
Tratamiento médico o terapia sistémica
La terapia sistémica es aquella que actúa sobre todo el organismo en contraste con un tratamiento local como es la cirugía o la radioterapia.
La terapia sistémica se administra o bien vía intravenosa o bien vía oral por lo que se distribuye a todos los órganos. Este tipo de terapia tiene su papel tanto en la enfermedad en estadio precoz (adyuvante o neoadyuvante) como cuando la enfermedad se presenta de forma diseminada o metastásica.
Existen diferentes tipos de tratamientos sistemáticos, que son:
Quimioterapia
Es el tratamiento que utiliza drogas para parar el crecimiento de las células tumorales matándolas directamente o haciendo que no puedan dividirse. La quimioterapia suele administrarse de forma intravenosa, aunque hay fármacos que se administran por vía oral.
Hormonoterapia
Hay varios tipos de terapias endocrinas disponibles. Atendiendo a su mecanismo de acción se clasifican en:
- Moduladores selectivos de los receptores de estrógenos (SERM) bloquean el RE en las células mamarias impidiendo que los estrógenos se unan a él. El tamoxifeno es un SERM.
- Degradadores selectivos de los receptores de estrógenos (SERD). Actuán como los SERM pero también reducen la cantidad de receptores de estrógeno y cambian la forma de los receptores de estrógeno de las células mamarias para que no puedan funcionar correctamente. El fulvestrant es un SERD que se administra por vía IM. En la actualidad se están investigando nuevos SERD que se administran por vía oral
- Análogos de la hormona liberadora de gonadotropina que producen supresión de la función ová La goserelina es el más utilizado en el cáncer de mama.
- Inhibidores de la aromatasa reducen la producción de estrógenos en los órganos donde se producen tras la menopausia o tras la supresión de la función ovárica . El anastrozol, letrozol y exemestano son inhibidores de la aromatasa.
Terapias dirigidas
Las terapias dirigidas son áquellos fármacos que identifican y atacan específicamente células tumorales sin dañar las células normales porque bloquean vías específicas de señalización de las células tumorales. En el tratamiento del cáncer de mama se utilizan muchos tipos de terapias dirigidas.
b. Anticuerpos Conjugados (ADCs). Son terapias que conjugan anticuerpos monoclonales con agentes quimioterápicos, unidos a través de un enlazador. El anticuerpo localiza la célula tumoral y se une a su superficie, “engañándola” para que la reconozca y le permita entrar en el interior. En cuanto está dentro de la célula, el agente quimioterápico actúa dañando o eliminando a la célula tumoral. Los anticuerpos conjugados aprobados para el tratamiento del cáncer de mama son el TDM-1, el trastuzumab deruxtecan y el sacituzumab govitecán.
c. Inhibidores de las ciclinas dependientes de kinasas. Son fármacos que bloquean unas proteínas que se llaman ciclinas dependientes de kinasas que son responsables del crecimiento de las células tumorales y que están implicadas en la resistencia a la hormonoterapia. Son ciclinas dependientes de kinasas, que se utilizan en el tratamiento del cáncer de mama: el ribociclib, el palbociclib y el abemaciclib. Estos tratamientos se administran en combinación con la hormonoterapia.
d. Inhibidores de la vía de PI3K.-AKT-mTOR. La ruta de señalización celular PI3K/AKT/mTOR es una vía que participa en la supervivencia celular y es activada por varios mecanismos que incluyen la pérdida de la función supresora de tumor de PTEN,o la amplificación o mutación de PI3K y AKT . La cativación de esta vía está relacionada con la resistencia a la terapia hormonal en el cáncer de mama luminal. El everolimus es un inhibidor de mTOR y alpelisib es un inhibidor de Pi3K.
e. Inhibidores de PARP. Son terapias dirigidas que bloquean la reparación del DNA haciendo que las células tumorales mueran al no poder reparar sus errores. Están indicados en el tratamiento de los cánceres de mama con mutaciones en los genes BRCA. Olaparib y talazoparib son inhibidores de PARP.
Inmunoterapia
La inmunoterapia aprovecha el sistema inmune del propio paciente para luchar contra el cáncer utilizando sustancias del propio organismo o creadas en el laboratorio para restaurar el sistema inmune del paciente. El pembrolizumab se ha aprobado para el tratamiento del cáncer de mama triple negativo en neoadyuvancia y enfermedad avanzada y atezolizumab en el tratamiento del cáncer de mama avanzado.
Incluso en etapas iniciales de la enfermedad, las células tumorales pueden propagarse a través de la sangre. No son detectables por su pequeño tamaño, pero si se dejan evolucionar pueden producir metástasis en otras partes del cuerpo. El tratamiento adyuvante intenta erradicar esas células para evitar que en un futuro produzcan metástasis. El objetivo principal del tratamiento adyuvante sistémico es reducir el riesgo de recaída y muerte.
Para valorar a quién se debe administrar tratamiento adyuvante debemos seleccionar a las pacientes que tienen más riesgo de recaída después de la cirugía. La valoración del riesgo de recaída se hace atendiendo a los factores pronóstico (afectación ganglionar, edad, tamaño del tumor, grado histológico o status de receptores y HER2).
En la actualidad hay también disponibles test genéticos que ayudan a determinar el riesgo de recurrencia basándose en el perfil genético del tumor. Hay ya comercializados varios de ellos que se pueden utilizar para calcular el riesgo de recaída en pacientes con tumores sin afectación ganglionar, receptores hormonales positivos y HER2 negativo. Además estos test pueden orientan sobre el beneficio o no de la quimioterapia adyuvante.
Existen diferentes modalidades de tratamiento adyuvante: la quimioterapia, la hormonoterapia y las terapias dirigidas. La utilización de una u otra o de varias en cada paciente depende del riesgo de recaída y del subtipo de cáncer de mama. Hay varios esquemas de tratamiento quimioterápico adyuvante.
Con respecto a la utilización de tratamiento hormonal, sólo se indica si el tumor expresa receptores hormonales. Habitualmente, el tratamiento hormonal se da tras finalizar la quimioterapia y puede durar entre 5 y 10 años. Para las mujeres premenopáusicas, el fármaco elegido es el tamoxifeno y para las postmenopáusicas, suele pautarse un inhibidor de la aromatasa. En las mujeres premenopáusicas muy jóvenes o que sigue reglando tras la quimioterapia puede indicarse suprimir la función ovárica durante un tiempo.
En este momento la terapia dirigida que se utiliza en el contexto adyuvante es el trastuzumab, que sólo es útil si el tumor tenía expresión aumentada de la proteína HER2. El trastuzumab se administra durante 1 año. TDM-1 está indicado como tratamiento adyuvante en las pacientes que no alcanzan una respuesta completa patológica tras el tratamiento neoadyuvante.En algunos casos de pacientes HER 2 se puede valorar también pertuzumab o el neratinib.
Tratamiento médico neoadyuvante
El tratamiento neoadyuvante es aquel que se administra previamente a la cirugía.
Hasta hace poco tiempo, el objetivo principal del tratamiento neoadyuvante era facilitar la cirugía. En tumores localmente avanzados, o que por su tamaño o por sus características no son operables de entrada se utiliza para disminuir el tamaño del tumor y hacer posible una cirugía completa.
En la actualidad el tratamiento neoadyuvante se utiliza para saber si ese tumor ha sido o no sensible a él y poder individualizar el tratamiento tras la cirugía. Además, el hecho de que un tumor desaparezca completamente con la quimioterapia hasta el punto de que tras la cirugía el patólogo no encuentre células tumorales en la pieza al analizarla con el microscopio, se considera un factor de muy buen pronóstico a largo plazo.
Cuando se administra tratamiento neoadyuvante, es recomendable marcar el tumor con algún material radiopaco para que al hacer la cirugía, el cirujano no tenga dificultades para la extirpación si el tumor disminuye mucho de tamaño o si desaparece.
Con respecto al tratamiento utilizado, puede utilizarse cualquier modalidad de tratamiento sistémico (hormonoterapia, quimioterapia o quimioterapia + una terapia dirigida o quimioterapia e inmunoterapia) dependiendo del subtipo de cáncer de mama. Está demostrado que el resultado de dar la quimioterapia antes o después de la cirugía es el mismo en cuanto a supervivencia.
En función de la respuesta patológica obtenida tras la neoadyuvancia se indicará el tratamiento adyuvante. De una forma general, si se obtiene una respuesta completa el tratamiento será el que indicamos en el apartado de tratamiento adyuvante de tumores operables (ver más adelante). En los tumores en que no se obtenga una respuesta completa el tratamiento será hormonoterapia en los tumores luminales, TDM 1 en los tumores HER2 positivos y quimioterapia con capecitabina en los tumores triple negativos.
Tratamientos según el estadio
A modo de guía y siguiendo la clasificación clásica analizaremos el tratamiento del cáncer de mama en estadios aunque en la actualidad cada vez toma más importancia el subtipo de cáncer de mama (luminal A, luminal B, HER2 o triple negativo) para plantear el tratamiento, ya que el pronóstico de estos tumores es muy diferente independientemente del estadio, así como su respuesta a los tratamientos.
ESTADIOS INICIALES, OPERABLES
- Cirugía conservadora o mastectomía con ganglio centinela o linfadenectomía si es necesaria.
- Quimioterapia adyuvante si los factores de riesgo lo aconsejan. Habitualmente la quimioterapia adyuvante se da de forma intravenosa en ciclos y dura entre 4-6 meses, dependiendo del esquema elegido. Los esquemas más comunes incluyen antraciclinas (doxorrubicina o epirrubicina) y taxanos (paclitaxel o docetaxel).
- Radioterapia adyuvante siempre que se haga cirugía conservadora o las características del tumor así lo aconsejen.
- Hormonoterapia adyuvante si el tumor tenía receptores hormonales positivos. El tratamiento varía si la paciente es premenopáusica en cuyo caso se prescribe tamoxifeno o postmenopaúsica. En este caso se pueden prescribir los inhibidores de la aromatasa. Habitualmente el tratamiento dura entre 5 y 10 años y es oral. En las mujeres premenopáusicas muy jóvenes o que sigue reglando tras la quimioterapia puede indicarse suprimir la función ovárica durante un tiempo.
- Trastuzumab adyuvante durante 1 año si el tumor era HER2 positivo. El trastuzumab se inicia con la quimioterapia con taxanos, se puede administrar a la vez que la radioterapia y durante la hormonoterapia. En algunos casos puede valorarse cambinar el Trastuzumab con pertuzumab o neratinib tras finalizar el Trastuzumab.
Actualmente suele considerarse tratamiento neoadyuvante previamente a la cirugía en tumores mayores de 2 cm o con afectación ganglionar.
ESTADIOS LOCALMENTE AVANZADOS, NO OPERABLES
- Hormonoterapia neoadyuvante. Puede utilizarse en tumores con receptores positivos y posteriormente plantear la cirugía.
- Quimioterapia con intención neoadyuvante. Se pautan 6 meses de tratamiento con quimioterapia y posteriormente se plantea la cirugía.
- Radioterapia tras la cirugía.
- El tratamiento adyuvante posterior se indicará en función de la respuesta patológica obtenida y del subtipo tumoral (ver apartado de tratamiento neoadyuvante).
ESTADIOS AVANZADOS
Se considera estadio IV cuando el tumor se ha extendido fuera de la mama. Esto puede ocurrir durante el seguimiento de un cáncer de mama inicialmente limitado y tratado como tal, o puede aparecer de inicio.
Cuando el cáncer de mama se extiende a otros órganos, la curación ya no es posible y el objetivo del tratamiento es la cronificación de la enfermedad y la paliación de los síntomas.
El tratamiento más importante en este estadio es el tratamiento sistémico (quimioterapia, hormonoterapia y/o terapias dirigidas) y la elección sobre uno u otro depende tanto de factores que afectan al tumor como a características de la paciente incluyendo sus deseos. El arsenal terapéutico es muy amplio en cáncer de mama y la decisión se toma habitualmente entre el oncólogo médico y la paciente.
Tratamiento hormonal
Sólo es útil en pacientes con tumores receptores hormonales positivos. Se considera su uso cuando sólo hay enfermedad en los huesos o en tejido blando. También se considera cuando hay afectación de órganos como el hígado o el pulmón pero con poca repercusión clínica (el paciente tiene pocos síntomas derivados de la afectación).
Con respecto al tipo de tratamiento hormonal, es importante tener en cuenta si la mujer es o no postmenopaúsica y si ha recibido tratamiento hormonal previo (por ejemplo como tratamiento adyuvante).
La estrategia principal en mujeres premenopáusicas consiste en bloquear los ovarios con tratamiento médico, quirúrgico o con radioterapia para conseguir que la mujer se comporte como postmenopáusica y poder ser tratada como tal. El tratamiento actualmente indicado es una combinación con inhibidores de ciclinas combinado con letrozol o fulvestrant tras haber bloqueado los ovarios.
Para las mujeres postmenopáusicas el tratamiento hormonal se basa en el uso de inhibidores de ciclinas combinados con letrozol o fulvestrant.
La duración del tratamiento va a depender de la respuesta que se obtenga al mismo y de la tolerancia. Habitualmente se mantiene el tratamiento mientras siga siendo efectivo. Cuando la enfermedad progresa, se puede plantear un cambio de tratamiento hormonal o pasar a tratamiento con quimioterapia.
Tratamiento con quimioterapia
Hay una gran variedad de agentes quimioterápicos activos en cáncer de mama (antraciclinas, paclitaxel, docetaxel, vinorelbina, capecitabina, carboplatino, gemcitabina, cisplatino, eribulina) y la decisión sobre qué fármaco o combinación de ellos se va a utilizar va a depender de varios factores: si se ha utilizado o no previamente quimioterapia y hace cuánto, si la paciente tiene alguna enfermedad que limite el uso de algún fármaco por sus efectos secundarios, de la edad de la paciente, de su estado general puesto que hay tratamientos más o menos agresivos o de si la afectación por el tumor está produciendo muchos síntomas y se necesita una rápida actuación del tratamiento.
Recientemente se ha aprobado también un anticuerpo conjudado, el sacituzumab govitecán para el tratamiento de segunda línea del CMM triple negativo.
En cuanto a la duración del tratamiento, tampoco hay un número de ciclos definidos y va a depender de la respuesta al tratamiento y de la tolerancia al mismo.
Tratamiento con terapias dirigidas
El tratamiento con quimioterapia tiene el problema de que es un tratamiento poco específico, la quimioterapia actúa sobre las células que se reproducen rápidamente, tanto tumorales como sanas y de ahí vienen muchos de sus efectos secundarios. Las terapias dirigidas intentan precisamente ser mucho más selectivas y por tanto más eficaces y menos tóxicas. En los últimos años se han desarrollado muchas terapias antidiana que han demostrado ser muy eficaces y que ya pueden utilizarse en la clínica.
Terapias anti-HER 2. Están indicadas en los tumores HER 2 positivos. La primera línea de tratamiento para la enfermedad avanzada en estos tumores incluye una quimioterapia con taxanos combinada con trastuzumab y pertuzumab. Recientemente ha sido aprobado un nuevo Anticuerpo conjudo el trastuzumab deruxtecán con indicación en segunda línea y posteriores .
Ahora disponemos de Otras moléculas que actúan contra el receptor HER2 y que pueden utilizarse en la enfermedad avanzada son el TDM-1 , el lapatinib o el neratinib .También sabemos que la combinación de terapias anti-HER2 es más efectiva que el bloqueo simple (pertuzumab+trastuzumab o lapatinib+trastuzumab).
Tratamientos antiangiogénicos. Estos fármacos actúan impidiendo que el tumor desarrolle vasos sanguíneos para nutrirse y crecer. En cáncer de mama está demostrada la actividad de Bevacizumab en combinación con quimioterapia.
Inmunoterapia
En las pacientes con tumores triple negativos la quimioterapia combinada con inmunoterapia es una opción de tratamiento de primera línea. Puede utilizarse el pembrolizumab o el atezolizumab.
Tratamiento con fármacos antiresortivos
Estos fármacos se utilizan cuando el tumor produce afectación de los huesos para disminuir el dolor y las complicaciones óseas como las fracturas y la elevación de los niveles de calcio en la sangre. Los más utilizados son el zolendronato y el denosumab.
Seguimiento del cáncer de mama
Tras completar el tratamiento para estadios precoces, las pacientes deben realizar un seguimiento apropiado.
El seguimiento debe hacerse cada 4-6 meses los 5 primeros años y luego de forma anual. Debe incluir historia clínica y exploración física así como una mamografía anual de la mama restante y de la contralateral. No está demostrado que un seguimiento estrecho con gran número de exploraciones aumente la supervivencia.
Si el tratamiento incluye el tamoxifeno, debe hacerse una revisión ginecológica anual (su uso se ha asociado con un aumento del riesgo de cáncer de útero).
Si el tratamiento incluye inhibidores de la aromatasa, debe incluir densitometrías periódicas para valorar la descalcificación ósea que pueden potenciar estos fármacos.
Tras el tratamiento del cáncer de mama no debe ganar peso, ya que el sobrepeso aumenta la posibilidad de recaer. Se recomienda también hacer una actividad física regular, ya que el ejercicio físico se relaciona con un mejor pronóstico.




