Prevención
Índice de navegación
1. Epidemiología y factores de riesgo del cáncer de mama
El cáncer de mama es un importante problema de salud pública debido a su alta incidencia, prevalencia y mortalidad. Se trata del tumor maligno más frecuente en mujeres a nivel mundial, con más de 1,67 millones de casos nuevos y más de medio millón de muertes por esta causa. Dentro de Europa existe un claro patrón geográfico, con mayor incidencia en Europa Occidental y del Norte y menor incidencia en Europa del Este, ocupando España una posición intermedia1. Se estima que en nuestro país en 2017 se diagnosticaron 26.370 casos nuevos y alrededor de 6.200 personas, casi todas mujeres, murieron por esta causa. De hecho, el cáncer de mama ocasiona la mayor mortalidad por cáncer en mujeres, seguido del cáncer colorrectal, pulmón y páncreas2.
En la últimas décadas los programas de detección precoz y los avances terapéuticos en el manejo de la enfermedad han logrado que la mortalidad por cáncer de mama descienda a un ritmo de un 1,8% anual, a pesar de que la incidencia continúa aumentando a un ritmo de un 1-2% anual. En la actualidad, la supervivencia del cáncer de mama a los 5 años del diagnóstico se eleva a un 80,3%, frente al 70% que presentaba en el periodo 85-892.
Existen distintos tipos de factores de riesgo, unos que se pueden controlar y otros que no. Factores de riesgo que no podemos controlar son el sexo, la edad, determinados factores genéticos y antecedentes familiares y personales. Pero hay otros factores que sí podemos controlar como el peso, la dieta, el ejercicio físico y el consumo de alcohol y de tabaco3.
1.1 La edad: es el principal factor de riesgo para el cáncer de mama. La incidencia de cáncer de mama aumenta a partir de los 45 a 50 años.
1.2 El género: el cáncer de mama es el tumor más frecuente en mujeres y ocurre hasta 100 veces más en las mujeres que en los hombres.
1.3 Factores familiares/hereditarios: las formas familiares comprenden casi el 20% de todos los tumores de mama, pero solo el 5-10% de los casos son hereditarios. Tener un familiar de primer grado con cáncer de mama duplica el riesgo mientras que mutaciones en determinados genes confieren un riesgo relativo 10-30 veces el de la población general. La presencia de mutaciones en genes de alta penetrancia como BRCA1, BRCA2, TP53, PTEN, CDH1 y otros que implican una alta probabilidad (>30-45%) de desarrollar este tumor, ocupan el primer lugar en cuanto a la magnitud de su efecto. Sin embargo, dada la rareza de estas mutaciones en población general, el riesgo atribuible a las mismas es relativamente bajo. Existen otros síndromes de moderado riesgo asociados a mutaciones en CHEK2, PALB2, ATM, que implican una probabilidad aumentada pero menor (20-30%) de desarrollar cáncer de mama.
1.4 Factores hormonales: Está claramente establecida la relación entre los niveles de estrógenos y el desarrollo de cáncer de mama. Así, son factores de riesgo la menarquia precoz (<12 años), la menopausia tardía, edad tardía del primer embarazo (>30 años) y la nuliparidad. Igualmente, el tratamiento hormonal sustitutivo conlleva un aumento del riesgo en las mujeres tratadas. Parece que la lactancia materna de larga duración (>12 meses) disminuye el riesgo de cáncer de mama. Por otro lado, el papel de los anticonceptivos orales, siguen siendo controvertido en relación al riesgo de cáncer de mama.
1.5 Factores dietéticos y estilo de vida: Las diferencias geográficas en la incidencia del cáncer de mama están en probable relación con la dieta, en concreto con la ingesta total de grasas. Se postula el papel protector de las frutas y verduras al disminuir la absorción de los estrógenos en el tubo digestivo, aunque estudios prospectivos no lo han confirmado. El sobrepeso es un factor de riesgo claro debido a que en mujeres menopáusicas la principal fuente de estrógenos es el tejido graso, además se ha establecido como factor de mal pronóstico. El ejercicio físico regular puede proteger a las mujeres premenopáusicas al alterar los ciclos ovulatorios y a las menopáusicas al prevenir la obesidad. La relación entre la ingesta de alcohol, el tabaco y las neoplasias de mama también ha sido establecida.
1.6 Factores ambientales y ocupacionales: Las radiaciones ionizantes, fundamentalmente en la infancia y la adolescencia, son factores de riesgo para el desarrollo de cáncer de mama. Las mujeres que recibieron irradiación del manto para el Linfoma Hodgkin antes de los 15 años tienen un riesgo significativamente mayor de cáncer de mama.
1.7 Lesiones premalignas: Las lesiones proliferativas con atipia, que incluyen la hiperplasia lobulillar y ductal, conllevan un aumento de riesgo de 4-5 veces. Otras lesiones mamarias proliferativas sin atipia incrementan el riesgo 1,5-2 veces. El carcinoma lobulillar in situ (CLIS) también se considera un marcador de alto riesgo (9-11 veces), mientras que el carcinoma ductal in situ (CDIS) podría considerarse una lesión premaligna invasiva.
1.8 Otros: Una mamografía con patrón denso es otro factor de riesgo.
Tabla 1. Factores de riesgo de cáncer de mama4
| RIESGO RELATIVO <2 | RIESGO RELATIVO 2-4 | RIESGO RELATIVO >4 |
|
|
|
La mujer promedio tiene entre un 10 y un 15% de probabilidades de desarrollar cáncer de mama si alcanza la edad de 90 años. La presencia de factores de riesgo ayuda a identificar a mujeres con mayor probabilidad de cáncer de mama que pueden beneficiarse de mayor vigilancia u otras medidas preventivas (quirúrgicas o farmacológicas). El hecho de tener uno o más factores de riesgo no quiere decir que se vaya a desarrollar un cáncer de mama y por el contrario, el no presentar ningún factor de riesgo no implica que no se pueda padecer la enfermedad.
2. Selección de mujeres candidatas a prevención farmacológica
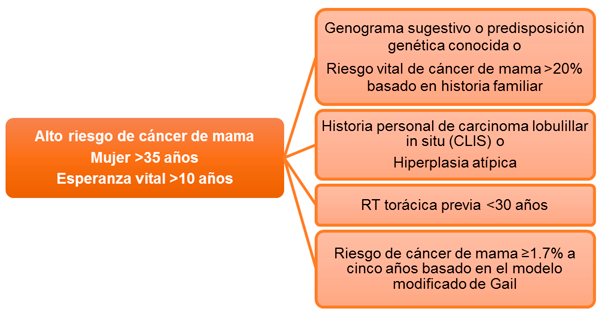
Debemos discutir los beneficios de la terapia endocrina en la prevención del cáncer de mama con mujeres con alto riesgo de este tumor según indican las guías National Comprehensive Cancer Network (NCCN)5, American Society of Clinical Oncology (ASCO)6, y United States Preventive Services Task Force (USPSTF)7. Los criterios de selección utilizados están basados en los ensayos de prevención e incluyen a mujeres con 35 años o más con una expectativa de vida de al menos 10 años y uno de los siguientes (Figura1):- Genograma sugestivo o predisposición genética conocida.
- Riesgo vital de cáncer de mama >20% basado en modelos que dependen de la historia familiar (BRCAPRO, BOADICEA).
- Historia personal de carcinoma lobulillar in situ (CLIS) o hiperplasia atípica.
- RT torácica previa antes de los 30 años de edad.
- Riesgo de cáncer de mama ≥1.7% a cinco años basado en el modelo modificado de Gail.
Guías americanas5, 7, 16
3. Prevención farmacológica con moduladores selectivos del receptor de estrógenos (SERM)
Tanto el tamoxifeno como el raloxifeno son opciones adecuadas para las mujeres con alto riesgo de cáncer de mama. En los ensayos de prevención el tratamiento en general se administró durante cinco años.
3.1 Tamoxifeno: a nivel de la glándula mamaria bloquea el efecto de los estrógenos, mientras que a nivel óseo o a nivel endometrial tiene un efecto agonista. Además de ser una opción de tratamiento para el cáncer de mama con receptores hormonales positivos, está aprobado en los Estados Unidos como quimioprevención en mujeres consideradas de alto riesgo. Los beneficios de los SERM en la prevención del cáncer de mama se resumen en el metaanálisis del USPSTF8 que incluye 7 ensayos randomizados con tamoxifeno y raloxifeno. Si nos centramos en los 4 ensayos que compararon el tamoxifeno frente a placebo, podemos concluir que el tamoxifeno:
- Reduce el riesgo de cáncer de mama (7 casos en 1000 mujeres en cinco años, RR 0.70; IC 95% 0.59-0.82), principalmente a costa de reducir el riesgo de cáncer de mama con receptores de estrógeno positivo.
- Disminuye de forma significativa la incidencia de fracturas no vertebrales (3 casos en 1000 mujeres, RR 0,66; IC 95% 0,45-0,98).
- No alcanza diferencias en mortalidad por cáncer de mama o por todas las causas.
Además de estos resultados, el seguimiento a largo plazo del Estudio Internacional de Intervención del Cáncer de Mama I (IBIS-1) mostró que el tamoxifeno produjo una reducción a largo plazo del riesgo de cáncer de mama con receptores hormonales positivos. En este estudio más de 7000 mujeres fueron asignadas aleatoriamente a cinco años de tamoxifeno o placebo. Con una mediana de seguimiento de 16 años9, el tamoxifeno redujo el riesgo de cáncer de mama infiltrante entre los 0 y 10 años (HR 0,72; IC 95% 0,59-0,88) y después de 10 años (HR 0,69; IC 95% 0.53-0.91). Como se había observado previamente, esta reducción del riesgo fue solo para el cáncer de mama con receptores hormonales positivos (HR 0,66; IC 95% 0,54-0,81), pero no para el cáncer de mama con receptores negativos (HR 1,05; IC 95% 0,71-1,57).
Si bien los beneficios del tamoxifeno están bien establecidos, el tratamiento también está asociado con efectos secundarios relevantes:
- Mayor incidencia de eventos tromboembólicos (4 casos en 1000 mujeres, RR 1.93; IC 95% 1.41- 2.64). Uno de los ensayo incluidos en el metaanálisis del USPSTF, el estudio P-1 del National Surgical Adjuvant Breast and Bowel Project (NSABP) mostró una tendencia hacia mayores tasas de ictus (1.75 versus 1.23 casos por 1000 mujeres, RR 1.42; IC 95% 0.97-2.08) y embolia pulmonar (0.69 versus 0.32 casos por cada 1000 mujeres, RR 2.15; IC 95% 1.08-4.51)10.
- Mayor incidencia de cáncer de endometrio (4 casos en 1000 mujeres, RR 2.13; IC 95% 1.36-3.32). En el estudio IBIS-1, el riesgo de cáncer de endometrio fue superior en los primeros cinco años de tratamiento (OR 3.76; IC 95% 1.20-15.56), pero no se observa mayor incidencia transcurridos los cinco años de tratamiento (OR 0.64; IC 95% CI 0.21-1,80)9.
Si bien los riesgos de tamoxifeno son mayores en comparación con el placebo, es importante señalar que la incidencia global de eventos adversos es pequeña.
3.2 Raloxifeno: de la misma familia que el tamoxifeno pero con efecto antagonista estrogénico sobre el endometrio. Además de su aprobación como agente para la prevención del cáncer de mama, está aprobado para el tratamiento de la osteoporosis en mujeres menopáusicas. Dentro del metaanálisis del USPSTF8, dos ensayos compararon el raloxifeno frente a placebo, y el raloxifeno ofrece:
- Una reducción en el riesgo de cáncer de mama infiltrante (0 casos en 1000 mujeres, RR 0,44; IC 95% 0,27-0,71). Al igual que con el tamoxifeno, el riesgo se redujo principalmente para el desarrollo de cáncer de mama con receptores de estrógenos positivos.
- Una reducción en la incidencia de fracturas vertebrales (7 casos en 1000 mujeres, RR 0,61; IC 95% 1,41-2,64).
- Sin aumento de la incidencia de cáncer de endometrio.
- Sin diferencias en la mortalidad por cáncer de mama o por todas las causas.
3.3 Elección de tamoxifeno versus raloxifeno:
- La administración de tamoxifeno o raloxifeno durante cinco años redujo la incidencia de cáncer de mama en 7 a 9 casos por cada 1000 mujeres. Uno de los ensayos incluidos en el metaanálisis del USPSTF, que comparó directamente el tamoxifeno con el raloxifeno (STAR P-2 trial), concluyó que el tamoxifeno fue un poco más eficaz en la prevención del cáncer de mama infiltrante (alrededor de un 24% superior al raloxifeno)11.
- El tratamiento con SERM no redujo significativamente el riesgo de cáncer de mama no invasivo o la mortalidad.
- En cuanto al perfil de toxicidad, tanto el tamoxifeno como el raloxifeno aumentan el riesgo de eventos tromboembólicos en comparación con el placebo (de 4 a 7 eventos por cada 1000 mujeres), el riesgo es mayor con el tamoxifeno. Además, el tamoxifeno provocó un mayor riesgo de cataratas y cáncer de endometrio (particularmente en mujeres mayores de 50 años).
- El raloxifeno sólo debe emplearse en mujeres menopáusicas
4. Prevención farmacológica con inhibidores de aromatasa (IA)
Los IA suprimen los niveles plasmáticos de estrógenos mediante la inhibición de la enzima aromatasa, que es responsable de la conversión periférica de andrógenos a estrógenos. Estos fármacos forman parte del tratamiento del cáncer de mama con receptores hormonales positivos en mujeres menopáusicas, de hecho demostraron una capacidad superior al tamoxifeno para prevenir la aparición de un segundo cáncer contralateral en mujeres tratadas de forma complementaria tras la cirugía. Dentro de los IA, solo anastrozol12 y exemestano13 han sido evaluados para prevención primaria y mostraron resultados similares.
4.1 Anastrozol: el International Intervention on Cancer Study (IBIS-II), incluyó aproximadamente 4000 mujeres menopáusicas con alto riesgo de cáncer de mama y las asignó al azar al tratamiento con anastrozol o placebo durante cinco años12. Los criterios de elegibilidad eran complejos y diferentes para cada grupo de edad, pero en general se definió como alto riesgo dos o más familiares de primer grado con cáncer de mama antes de los 50 años, o madre o hermana con cáncer de mama bilateral o historia personal de carcinoma lobulillar in situ (CLIS) o hiperplasia atípica. Tras una mediana de seguimiento de 5 años, se observó:
- Una reducción del 50% en el riesgo de cáncer de mama infiltrante en el brazo con anastrozol en comparación con placebo (32 [2%] versus 64 [3%], respectivamente, HR 0,47; IC del 95% 0,32-0,68). Además el anastrozol produjo una disminución similar en la incidencia de carcinoma ductal in situ (CDIS).
- De forma significativa más efectos secundarios musculo-esqueléticos (64 frente a 58%), hipertensión (5 versus 3%), sequedad vaginal (19 versus 16%) y síntomas vasomotores (57 frente a 49%).
4.2 Exemestano: su buen perfil de eficacia y tolerancia motivaron su elección para el estudio de quimioprevención MAP-3/ExCel13. En este ensayo se incluyeron 4.560 mujeres menopáusicas con alto riesgo para cáncer de mama, incluidas más de 400 mujeres españolas por medio del Grupo Español de Investigación del Cáncer de Mama (GEICAM). Se consideró alto riesgo a una puntuación superior a 1,67 en el test de Gail o antecedentes de lesiones mamarias de alto riesgo (hiperplasia ductal atípica, carcinoma lobulillar in situ o carcinoma intraductal tras mastectomía simple). Los resultados finales mostraron:
- Una reducción del 65% en la incidencia de cáncer de mama infiltrante en el brazo con exemestano en comparación con la rama placebo.
- Un perfil de toxicidad más favorable, los efectos secundarios fueron únicamente un 3% superiores en la rama de tratamiento activo. Incluso los trastornos musculoesqueléticos asociados a los IA fueron menores de lo esperado con escasa repercusión en la calidad de vida14.
En general, estos datos indican que los IA son una alternativa razonable a los SERM para las mujeres menopáusicas, aunque no se ha aprobado ninguno de estos fármacos para esta indicación.
5. Recomendaciones de las agencias
5.1 Las guías actualizadas en 2013 de la United States Preventive Services Task Force (USPSTF)15 apoyan la administración SERM (tamoxifeno o raloxifeno) para disminuir la incidencia de cáncer de mama infiltrante en mujeres de alto riesgo. El tamoxifeno fue más efectivo que el raloxifeno, pero también generó más cáncer de endometrio y cataratas. Ambos aumentan los eventos tromboembólicos.
5.2 La Sociedad Americana de Oncología Médica (ASCO)16 recomienda específicamente, en mujeres premenopáusicas tamoxifeno y en menopáusicas, tamoxifeno, raloxifeno o exemestano, siempre que se cumplan los criterios establecidos en los ensayos clínicos (riesgo a 5 años ≥1,66%, carcinoma lobulillar in situ o hiperplasia atípica) y siempre individualizando el consejo en función de los riesgos y beneficios de cada caso particular.
Debido a que los datos del ensayo International Intervention on Cancer Study (IBIS-II), se publicaron en 2014, ninguna de estas organizaciones incorpora el anastrozol como opción de tratamiento.
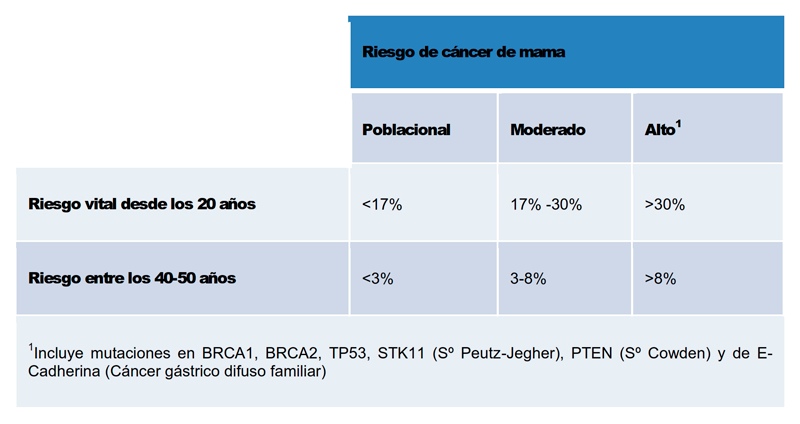
5.3 En 2017 se realiza la última enmienda de las guías del “National Institute for Health and Care Excellence británico” (NICE), donde se recomiendan tamoxifeno, raloxifeno y anastrozol como agentes con un coste-utilidad positivos para la prevención farmacológica del cáncer de mama, incluso aunque no han seguido el proceso formal de aprobación de esta indicación en dicho país17. Para esta agencia serán mujeres candidatas a quimioprevención aquellas con riesgo de cáncer de mama “moderado” (entre un 17 y un 30% para toda la vida o entre 3-8% en la década de los cuarenta) o “alto” (> 30% de riesgo vital total o > 8% en la década de los 40) (tabla 2). La elección del agente se basa en el perfil de efectos secundarios:
- Tamoxifeno para mujeres premenopáusicas, a menos que tengan un alto riesgo de enfermedad tromboembólica o cáncer de endometrio.
- Anastrozol en mujeres menopáusicas a menos que tengan osteoporosis severa.
- En mujeres menopáusicas con osteoporosis grave o que no desean tomar anastrozol, se ofrece tamoxifeno o si tienen mayor riesgo de cáncer de endometrio, se considera raloxifeno.
- No se recomienda mantener el tratamiento más allá de 5 años.
- No se recomienda prevención farmacológica en mujeres tras una mastectomía bilateral de reducción de riesgo.
![]()
- La adopción de un estilo de vida saludable, incluyendo la eliminación del tabaco, la reducción o eliminación del alcohol, la reducción alimentos ricos en grasas y en hidratos, el incremento de productos vegetales (verduras, frutas, cereales integrales) y la reducción/eliminación de tratamientos hormonales, es una estrategia eficaz en la prevención del cáncer de mama en la población general.
- En mujeres de alto riesgo, se recomienda valorar otras medidas preventivas incluyendo la mastectomía y ooforectomía profilácticas y la prevención farmacológica.
- En relación a la prevención farmacológica del cáncer de mama, tanto los SERM (tamoxifeno y raloxifeno) como los IA (exemestano y anastrozol) parecen ser opciones razonables, aunque solo el tamoxifeno y el raloxifeno han recibido aprobación de la FDA. Desconocemos si la quimioprevención con IA es más eficaz que un SERM, ya que no se han comparado directamente.
- Es importante comentar los riesgos y los beneficios de los tratamientos preventivos disponibles para que las mujeres con mayor riesgo puedan optar a su uso.
Bibliografía
1. Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase. No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer. doi:10.1016/j.ucl.2013.01.011.
2. Área de Epidemiología Ambiental y Cáncer. Mortalidad por cáncer en España.
https://www.isciii.es/QuienesSomos/CentrosPropios/CNE/EpidemiologiaCancerAmbiental/Paginas/default.aspx
3. DynaMed Plus [Internet]. Ipswich (MA): EBSCO Information Services. 1995 - . Record No. 901178, Risk factors for breast cancer; [updated 2018 Jun 01]; [about 24 screens]. Available from. http://www.dynamed.com/
4. Warner E. Breast-Cancer Screening. N Engl J Med. 2011;365(11):1025-1032. doi:10.1056/NEJMcp1101540
5. NCCN Guidelines for Detection, Prevention, & Risk Reduction: Breast Cancer Risk Reduction.
https://www.nccn.org/professionals/physician_gls/pdf/breast_risk.pdf (Accessed on August 30, 2018).
6. Visvanathan K, Chlebowski RT, Hurley P, et al. American society of clinical oncology clinical practice guideline update on the use of pharmacologic interventions including tamoxifen, raloxifene, and aromatase inhibition for breast cancer risk reduction. J Clin Oncol 2009; 27:3235.
7. Medications for Risk Reduction of Primary Breast Cancer in Women.
https://jamanetwork.com/journals/jama/fullarticle/2749220 (Accessed on August 30, 2018).
8. Nelson HD, Smith ME, Griffin JC, Fu R. Use of medications to reduce risk for primary breast cancer: a systematic review for the US Preventive Services Task Force. Annals of Internal Medicine 2013; 158(8): 604-614.
9. Cuzick J, Sestak I, Cawthorn S, et al. Tamoxifen for prevention of breast cancer: extended long-term follow-up of the IBIS-I breast cancer prevention trial. The Lancet Oncology. 2015;16(1):67-75. doi:10.1016/S1470-2045(14)71171-4.
10. Fisher B, Costantino JP, Wickerham DL, et al. Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer Inst 2005; 97:1652.
11. Vogel VG, Costantino JP, Wickerham DL, et al. Update of the National Surgical Adjuvant Breast and Bowel Project Study of Tamoxifen and Raloxifene (STAR) P-2 Trial: Preventing breast cancer. Cancer Prev Res (Phila) 2010; 3:696-706.
12. Cuzick J, Sestak I, Forbes JF, et al. Anastrozole for prevention of breast cancer in high-risk postmenopausal women (IBIS-II): an international, double-blind, randomised placebo-controlled trial. Lancet 2014; 383:1041-8.
13. Goss PE, Ingle JN, Alés-Martínez JE, et al. Exemestane for breast-cancer prevention in postmenopausal women. N Engl J Med 2011; 364:2381-91.
14. Maunsell E, Goss PE, Chlebowski RT, Ingle JN, Alés-Martínez JE, Sarto GE, et al. Quality of life in MAP.3 (Mammary Prevention 3): a randomized, placebo-controlled trial evaluating exemestane for prevention of breast cancer. J Clin Oncol. 2014 May 10;32(14):1427-36.
15. Heidi D. Nelson, MD, MPH; M.E. Beth Smith, DO; Jessica C. Griffin, MS; and Rongwei Fu, PhD. Use of Medications to Reduce Risk for Primary Breast Cancer: A Systematic Review for the U.S. Preventive Services Task Force. Ann Intern Med. 2013;158(8):604-614.
16. Visvanathan K, Hurley P, Bantug E, et al. Use of pharmacologic interventions for breast cancer risk reduction: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 2013; 31:2942-62.
17. http://guidance.nice.org.uk/CG164




