Tumores cerebrales
Índice de navegación
AUTOR: Dr. Pedro Pérez Segura
El objetivo principal de este documento es el de ayudarle a conocer mejor los tumores cerebrales y esperamos que le sea de utilidad.
En general, denominamos tumor cerebral a la presencia de una ”masa” que crece dentro del cerebro. Los tumores cerebrales que se originan en el propio cerebro se denominan primarios y los denominados secundarios, es decir, los que llamamos metastásicos, son aquellos tumores que se originan en otra parte del organismo como por ejemplo el pulmón o la mama u otro origen y que en algún momento de su evolución se extienden al cerebro.
Los tumores cerebrales de la infancia que no trataremos en este documento, son en su inmensa mayoría primarios al contrario de lo que ocurre en los adultos en los que la mayoría de los tumores cerebrales son metastásicos, es decir, que provienen de tumores de otro origen (pulmón y mama principalmente).
A lo largo de este documento nos referiremos casi de forma exclusiva a los tumores cerebrales malignos y primarios del adulto que a diferencia de los benignos crecen de forma más rápida y agresiva, son más invasivos y pueden ser amenazantes para la vida.
Anatomía
El cerebro es la estructura principal responsable de la coordinación y del control del organismo.
Se trata de una masa de tejido blanda protegida por los huesos del cráneo y unas membranas, las meninges. El líquido cefalorraquídeo fluye por el cerebro y discurre entre las meninges a través de otros espacios denominados ventrículos. No tiene drenaje linfático (salida a través de los ganglios) y la diseminación a través de la sangre es muy rara, por lo que los tumores cerebrales primarios, es decir, los que se originan en el cerebro casi nunca se extienden al resto del organismo salvo en algún tipo muy concreto de tumor cerebral.
El cerebro es una estructura muy compleja que procesa y memoriza muchísima información de forma continuada. Está constituido por el encéfalo (hemisferios cerebrales, tronco del encéfalo y cerebelo (Figura 1) y por la médula espinal (Figuras 1 y 2) que se encuentran alojados dentro de unas estructuras óseas que son el cráneo y la columna vertebral respectivamente. Está cubierto por las meninges, de las que existen tres capas (duramadre, aracnoides y piamadre), que protegen al cerebro y a la médula espinal. El conjunto de todas estas diferentes partes se denomina Sistema Nervioso Central (SNC).
El SNC controla a través de diferentes capacidades mentales como la memoria, la inteligencia, el habla y las emociones y también sentidos como la visión el gusto, el tacto o el oído o también funciones básicas como la respiración o la frecuencia cardíaca.
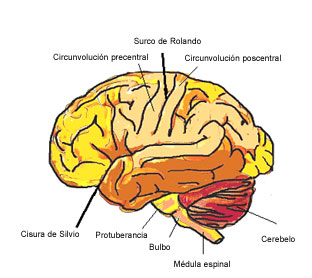
Figura 1: Vista lateral del encéfalo (hemisferios cerebrales, tronco y cerebelo)
EN: Manifestaciones Clínicas. Fernández Fernández, Oscar y cols. Servicio de Neurología. HRU Carlos Haya, Málaga. Tumores del Sistema Nervioso Central en el adulto y en la infancia. Enfoque multidisciplinar neurooncológico. Editores: M. Benavides, MA Arraez, I. Herruzo, T. Acha. Editorial Nova Sidonia 2012. Reproducido con permiso.
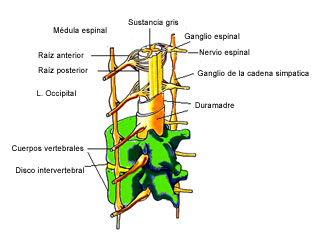
Figura 2: Anatomía de la médula espinal con su envoltura
EN: Manifestaciones Clínicas. Fernández Fernández, Oscar y cols. Servicio de Neurología. HRU Carlos Haya, Málaga. Tumores del Sistema Nervioso Central en el adulto y en la infancia. Enfoque multidisciplinar neurooncológico. Editores: M. Benavides, MA Arraez, I. Herruzo, T. Acha. Editorial Nova Sidonia 2012. Reproducido con permiso.
El cerebro a su vez contiene dos hemisferios unidos por una estructura denominada cuerpo calloso y se divide en 4 lóbulos (Figura 3):
Frontal: controla el razonamiento, las emociones, parte del habla y de los movimientos.
Parietal: controla las sensaciones del contacto, el dolor, la temperatura y partes del habla.
Temporal: controla la memoria, sentido del oído, y partes del habla.
Occipital: controla la visión.

Figura 3: Lóbulos cerebrales (frontal, parietal, temporal y occipital). EN: Manifestaciones Clínicas. Fernández Fernández, Oscar, Tamayo Toledo, José Antonio, Bravo Utrera, Mariano. Servicio de Neurología. Hospital Regional Universitario Carlos Haya, Málaga. EN: Tumores del Sistema Nervioso Central en el adulto y en la infancia. Enfoque multidisciplinar neurooncológico. Editores: M. Benavides, MA Arraez, I. Herruzo, T. Acha. Editorial Nova Sidonia 2010 (En prensa).
El cerebelo se sitúa en la parte posterior del cráneo y es el responsable principalmente de la coordinación y del equilibrio. La médula espinal se encuentra dentro de la columna vertebral y se extiende a continuación del encéfalo. Está también protegida por las meninges y sirve de comunicación con el resto del organismo.
Epidemiología
En España, según datos de los registros poblacionales de cáncer que abarcan a un 25% aproximadamente de la población española, los tumores primarios del SNC representan un 2% del total del cáncer en el adulto y hasta casi un 15% en los niños menores de 15 años; lo que nos indica que se trata, al menos en los adultos, de un tumor poco frecuente siendo su incidencia mayor en los hombres.
La mortalidad podría estar estabilizada como consecuencia de los avances, tanto en las técnicas diagnósticas de imagen como en las múltiples mejorías obtenidas con los tratamientos. En cuanto al tipo histológico (variedad de tumor), los más frecuentes son los denominados meningiomas seguidos de los gliomas.
Etiología. Factores de riesgo
Un factor de riesgo es aquello que incrementa la posibilidad de que una persona desarrolle una enfermedad, en nuestro caso el cáncer cerebral. Sin embargo, en la mayoría de los tumores no conocemos bien el porqué ese factor puede producirla. También es importante saber que hay personas que aunque tengan varios factores de riesgo nunca desarrollarán la enfermedad, mientras que otras que no los tienen, lo harán; lo que nos demuestra las limitaciones de los mismos.
En el caso de los tumores cerebrales, se desconocen las causas que pueden originarlos. Factores genéticos, ambientales, virus, radiaciones y traumatismos han sido considerados como posiblemente implicados en el desarrollo de los mismos, pero es muy probable que sean mecanismos múltiples que actúan sobre bases genéticas.
Factores genéticos
La predisposición genética (riesgo de transmisión) puede que tenga un papel en el desarrollo de los tumores cerebrales, pero no se puede decir que en la actualidad haya datos claros para considerar que algunos tumores cerebrales puedan ser hereditarios. Sin embargo, sí existen síndromes hereditarios en los que los tumores cerebrales forman parte del global, como por ejemplo en algunas enfermedades raras como la neurofibromatosis (tumoraciones múltiples en la piel y en el sistema nervioso con formas y grados distintos) entre otras.
Con la publicación del Genoma Humano y los continuos avances derivados de ello es posible que pueda encontrarse algún gen asociado al desarrollo de los tumores cerebrales. Un proyecto denominado Atlas del Genoma del cáncer está también catalagondo los cambios genéticos en múltiples tumores entre ellos el glioblastoma (tipo de tumor cerebral) en el que ya se han descrito diferentes vías que pueden ayudar a explicar cómo se desarrollan.
Cambios en los cromosomas
Cada célula del cuerpo humano tiene 23 pares de cromosomas y se ha visto que algunos tipos de tumores cerebrales pueden perder o ganar alguna pieza (brazo) de los mismos. Los cambios más conocidos y frecuentes descritos en algunos tumores cerebrales como los denominados oligodendrogliomas pueden ocurrir en los cromosomas 1 y 19 y los avances en el conocimiento de dichas alteraciones están ayudando en gran manera al tratamiento de los mismos.
Traumatismos
Los pocos datos disponibles en la especie humana, que además en ocasiones son contradictorios, no permiten establecer en la actualidad una relación causa-efecto entre traumatismo y tumor cerebral.
Radiaciones
En el medio ambiente que nos rodea existen diversos tipos de radiaciones y algunas pueden resultar peligrosas para las células humanas al modificar su estructura genética. Las que más nos interesan son las radiaciones llamadas ionizantes que se utilizan en el diagnóstico (rayos X o gamma) y/o tratamiento (radioterapia) de diferentes tipos de tumores, incluyendo los cerebrales.
No existen argumentos consistentes para relacionar el desarrollo de tumores cerebrales con la mayor parte de las radiaciones a las que estamos expuestos en la vida diaria. Las radiaciones no ionizantes no inducen necesariamente lesiones de carácter oncogénico, aunque no se puede descartar esta posibilidad. Los campos electromagnéticos entre los que se encuentran los que provienen de los teléfonos móviles, podrían incrementar el riesgo, aunque los resultados de los múltiples estudios científicos llevados a cabo tanto en Europa como en Estados Unidos son controvertidos. En cualquier caso, se recomiendan limitaciones en el uso de los mismos, en particular en las personas jóvenes aconsejándose el uso de auriculares. También se ha estudiado si existe mayor riesgo en función del tiempo durante el cual se ha utilizado un teléfono móvil con resultados también en ocasiones controvertidos. En general, la mayoría de los estudios concluyen que no existe una asociación consistente entre el uso de teléfonos móviles y el riesgo de desarrollar un tumor cerebral aunque si pudiera ser que se incrementara en función del tiempo durante el cual se ha utilizado. En definitiva, son necesarios más estudios y más tiempo para intentar conocer mejor la relación o no entre el uso de teléfonos móviles y tumores cerebrales tanto benignos como malignos.
Virus
No se ha podido hasta ahora establecer al menos en la especie humana, una clara asociación entre ciertos virus y el desarrollo de tumores cerebrales.
Sustancias químicas
Dentro de los compuestos químicos con capacidad de desarrollar tumores cerebrales de forma directa o indirecta podemos destacar los compuestos nitrosos presentes en el medio ambiente y que poseen capacidad para inducir tumores cerebrales, con riesgo potencial tanto para animales como para el hombre.
Otros factores de riesgo
El sexo masculino (más frecuentes en los hombres que en las mujeres), la raza (más frecuentes en la raza blanca) y la edad (más frecuentes en los niños).
Signos y síntomas
El cerebro tiene pocas posibilidades de expandirse (crecer) al estar rodeado de una estructura ósea rígida y cerrada que es el cráneo. Por ello, cuando aparece un tumor y crece, los síntomas se presentan en general de forma rápida y brusca. Los síntomas variarán en función del área(s) afectada(s) y pueden ser variados. Un tumor cerebral puede debutar con crisis epilépticas (convulsiones) o con síntomas generales como la falta de concentración, lentitud de pensamiento, cambios de carácter o comportamiento (denominados cognitivos), o también con síntomas secundarios debidos al incremento de la presión intracraneal (dolor de cabeza, vómitos) o finalmente con síntomas más relacionados con la localización del tumor como pueden ser alteraciones en los movimientos o del lenguaje, etc.
Si el paciente ha presentado alguna crisis convulsiva (Ver más adelante: convulsiones), los antiepilépticos permitirán tratarla y también reducirán el riesgo de que aparezcan de nuevo. Pueden producir efectos secundarios y también interacciones (incompatibilidades) con otros medicamentos, por lo que no se pueden tomar sin supervisión médica. Para mejorar algunos de los diferentes síntomas que pueden aparecer es frecuente el uso de un medicamento que se llama dexametasona, que reduce el edema que puede aparecer rodeando al tumor y permite la mejoría parcial o total de los síntomas. Pueden producir importantes efectos secundarios y cuando ya no son necesarios se tienen que retirar de forma programada poco a poco por lo que su médico le aconsejará en este sentido.
Los síntomas iniciales de un tumor cerebral dependerán principalmente de la localización del mismo (Ver Apartado de Anatomía).
En tumores de los lóbulos frontales pueden aparecer alteraciones denominadas motoras como parálisis de la cara o extremidades, trastornos del lenguaje, trastornos de la función cognitiva (cambios de humor y falta de atención), alteraciones de la conducta y de la personalidad e incontinencia (pérdida) urinaria y/o intestinal.
En tumores de los lóbulos temporales pueden aparecer trastornos visuales, o auditivos o del equilibrio o del olfato y gusto. También trastornos del lenguaje o de la memoria así como alteraciones emocionales y de la conducta.
Los lóbulos parietales no tienen una buena separación del resto de lóbulos lo que ocasiona manifestaciones clínicas más complejas. Se pueden presentar diversos síntomas como trastornos visuales o dificultad en el reconocimiento de objetos o de partes del cuerpo o del lenguaje.
En los tumores de los lóbulos occipitales destacan sobre todo los trastornos visuales incluyendo la ceguera.
Otras muchas localizaciones más concretas pueden determinar una variedad importante de síntomas que hacen necesaria la consulta con el médico para determinar su origen y pruebas necesarias a llevar a cabo.
Convulsiones
Una convulsión es un síntoma que traduce una actividad anormal en el cerebro. Puede aparecer como consecuencia de un tumor cerebral pero también existen otras causas desencadenantes que pueden originarlas y no son específicas de un tumor cerebral pues pueden darse en otras enfermedades.
Se pueden manifestar de diferentes formas e intensidades que pueden ir desde mínimos movimientos de muy corta duración a situaciones que conllevan pérdida de conocimiento y/o movimientos totalmente incontrolados. Dependen también de que parte del cerebro se encuentra afectada. Cuando las convulsiones se repiten las denominamos entonces epilepsia. Pueden repetirse de forma repentina incluso mucho tiempo después de haber aparecido por lo que en general pero no siempre precisan un tratamiento médico prolongado y un modo de vida adaptado. Cuando esto ocurre a veces aparece alguna señal (dolor de cabeza, cambio de comportamiento u otras) que llamamos aura y que puede anunciarnos la aparición de la convulsión y por lo tanto ayudarnos a controlarla (dejar de comer si lo estás haciendo, sentarse si se está de pie etc.).
Por todo esto es importante que nuestro entorno esté informado de ello y que permanezcamos tranquilos, pues la mayoría de las veces no precisan cuidados mayores. Sí es importante observar al paciente y llamar a la urgencia si las convulsiones son de primera aparición o existen problemas de respiración o no ceden rápidamente.
Existen básicamente dos tipos de convulsiones, las denominadas parciales y las generalizadas. Las parciales pueden empezar en una parte del cuerpo y luego extenderse a otras áreas y puede o no haber pérdida de conocimiento durante las mismas. Pueden también cursar con movimientos incontrolados. Las convulsiones generalizadas pueden ser de diferentes tipos y en general de mayor intensidad y gravedad con pérdida de conocimiento y/o descontrol de esfínteres (vesical y/o anal) .
El tratamiento de las convulsiones se hace principalmente con medicamentos antiepilépticos y sirven tanto para tratarlas cuando aparecen como para prevenirlas. Existen diferentes tipos de medicaciones y es el médico el que aconsejará de como se deben tomar así como de informar sobre los efectos secundarios y de los controles y modo de vida que deberá llevar el paciente. El control del tumor mediante la cirugía es también un tratamiento fundamental para las convulsiones aunque puede ser necesario tomar la medicación independientemente de que el tumor se haya quitado con la cirugía.
El tratamiento médico de las convulsiones puede precisar en ocasiones mantener unos niveles en sangre adecuados del o de los medicamentos que se están tomando para controlarlas o prevenirlas por lo que puede ser necesario tener controles de sangre para ello. Es importante también saber que los medicamentos antiepilépticos pueden interaccionar (potenciar o disminuir) con otros medicamentos.
La conducción de vehículos suele estar prohibida en pacientes que toman antiepilépticos y situaciones particulares como por ejemplo los baños en el mar o piscina deben estar supervisados.
Diagnóstico
En general para diagnosticar un tumor cerebral necesitamos la combinación de varias pruebas que nos permitirán determinar de la forma más precisa el diagnóstico, grado de actividad y extensión del tumor.
Los métodos diagnósticos más relevantes son los siguientes:
Exploración física y neurológica: El examen clínico del paciente es lo primero que se debe realizar y consiste en la valoración por parte del médico de la situación clínica y de los diferentes signos y síntomas del paciente, que le permitirán sospechar la afectación neurológica y decidir las pruebas a efectuar. Una exploración neurológica básica incluye conocer aspectos como los movimientos de los ojos, visión, oído, reflejos, coordinación y sentidos entre otros.
Pruebas radiológicas: Las técnicas de imagen son imprescindibles en el diagnostico de los tumores cerebrales. Su utilidad se basa en poder determinar la extensión del tumor, número de lesiones, tamaño y zonas afectadas; permiten también detectar posibles complicaciones secundarias al tumor, como la hemorragia, y son una herramienta complementaria a la valoración de signos y síntomas para hacer un diagnostico diferencial (distinguir el tumor de otra enfermedad).
Contamos con diferentes técnicas:
Tomografía Axial Computerizada (TAC)
 Se trata de una máquina emisora de rayos X y conectada a un sistema informático que nos facilita la obtención de imágenes de la cabeza, en forma de cortes desde diversos ángulos (Figura 4). Permite distinguir, con gran resolución, las alteraciones que condicionan y la localización de los tumores. En general, es necesario administrar un producto de contraste (yodado) para mejorar la visualización de las diferentes estructuras. Durante la exploración, que no es dolorosa, es necesario permanecer quieto.
Se trata de una máquina emisora de rayos X y conectada a un sistema informático que nos facilita la obtención de imágenes de la cabeza, en forma de cortes desde diversos ángulos (Figura 4). Permite distinguir, con gran resolución, las alteraciones que condicionan y la localización de los tumores. En general, es necesario administrar un producto de contraste (yodado) para mejorar la visualización de las diferentes estructuras. Durante la exploración, que no es dolorosa, es necesario permanecer quieto.
Figura 4: TAC con inyección de contraste. Tumor cerebral situado a nivel de los lóbulos parietal y occipital
Resonancia Magnética (RM)
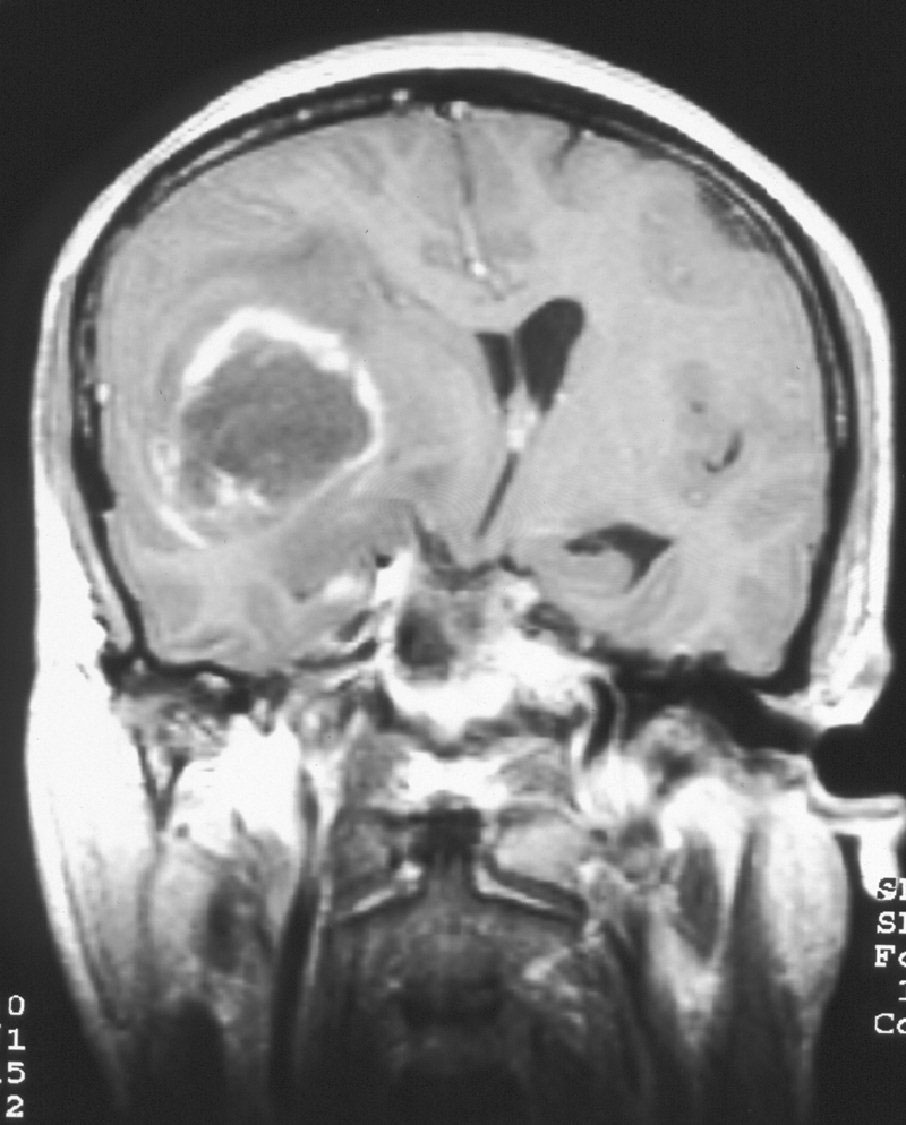
A diferencia del TAC, no precisa emitir rayos X para transmitir imágenes de la zona estudiada. La imagen se consigue empleando campos magnéticos, por lo que su uso puede estar contraindicado en personas portadoras de algún tipo de elemento metálico en el interior del cuerpo. También precisa la inyección de un producto de contraste (gadolinio), pero diferente al utilizado en el TAC. Permite ver con gran claridad cualquier alteración y en el caso de los tumores cerebrales es la prueba diagnóstica de primera elección; es la que permite las imágenes más precisas de los tumores, tanto en cuanto a su número como en cuanto a su localización o sus características (Figura 5).
Figura 5: RM tras administración de contraste donde se observa el tumor
Durante su realización el paciente permanece acostado en una camilla que se introduce en un cilindro y que puede provocar una sensación de claustrofobia, aunque también existen aparatos de resonancia abiertos. Contamos hoy en día con nuevas técnicas de RM denominadas de difusión, perfusión (estudian la vascularización) y espectroscopia (composición química del tumor) que utilizamos para recoger otro tipo de información muy necesaria acerca de los tumores cerebrales. Esta última técnica (espectroscopía) no proporciona imágenes como tales sino que aporta información sobre patrones de actividad tumoral basada en la medición de metabolitos y puede ser de utilidad en determinados tumores cerebrales como los denominados de bajo grado o para diferenciar recaídas de la enfermedad o para diagnosticar la radionecrosis que es una toxicidad tardía de la radioterapia.
PET (Tomografía por Emisión de Positrones)
La PET permite visualizar y cuantificar múltiples procesos bioquímicos de las células tumorales que son captados por una cámara especial tras la administración al paciente de un trazador o radiofármaco que puede detectar estas células.
La PET aporta información complementaria a otras técnicas diagnósticas (TAC y RM) en el estudio de determinados órganos como puede ser el cerebro. Se tolera en general muy bien y se puede utilizar en el diagnóstico diferencial con otras enfermedades o para establecer la extensión del tumor, sus características de comportamiento, o para evaluar la eficacia de los tratamientos efectuados o sus secuelas. Puede también complementar la información de la resonancia magnética en casos seleccionados. Esta prueba no aporta información anatómica detallada como la RM pero se pueden obtener imágenes fusionadas de PET con TAC o RM.
SPECT (Tomografía por emisión de fotón único)
La tomografía por emisión de fotón único (Single Photon Emission Computer Tomography) es una técnica mediante la que se analiza la información proporcionada por un radiotrazador (fármaco administrado normalmente por vía intravenosa). Esta técnica de imagen aunque no suele ser efectuada inicialmente en el diagnóstico de un tumor cerebral, nos puede aportar información en otros momentos de la evolución que se complementa con las otras descritas previamente. Permite un análisis más funcional, es decir, que informa sobre el grado de malignidad de un tumor y puede ser de gran utilidad en el seguimiento de tumores cerebrales.
Punción Lumbar (PL)
Una PL es un procedimiento mediante el cual un médico toma una muestra de líquido cefalorraquídeo (LCR) para analizarlo luego al microscopio y buscar células tumorales o algún signo de infección. Es una prueba de interés particular en algunos tumores cerebrales como el denominado linfoma primario cerebral o en tumores germinales cerebrales entre otros. También podemos efectuar una PL con el objetivo de introducir fármacos y así realizar un tratamiento del sistema nervioso. El LCR es, como su propio nombre indica, un líquido transparente que discurre alrededor del cerebro y de la médula espinal, a los que protege actuando como un almohadillado. El procedimiento se lleva a cabo introduciendo una aguja generalmente entre la tercera y la cuarta vértebra lumbar. Una vez finalizada la punción, el paciente debe guardar reposo para prevenir los efectos secundarios, siendo el más frecuente la cefalea (dolor de cabeza). En algunos casos no se puede llevar a cabo como cuando existe un aumento de la presión intracraneal.
Biopsia
La biopsia es esencial, básica y necesaria para efectuar el diagnóstico. Es la única prueba que permite llevar a cabo el análisis al microscopio de una muestra del tumor para confirmar con seguridad el diagnóstico definitivo, lo que es imprescindible para planificar el mejor tratamiento. Esto detectará si hay células tumorales, de qué tipo son y cuál es su agresividad. La obtención de una muestra suele realizarse mediante una biopsia, lo que se lleva a cabo en una intervención, en general, compleja. Los neurocirujanos (cirujanos especialistas del cerebro), hoy en día, pueden obtener una muestra de varias maneras:
- Biopsia estereotáxica: se realiza una pequeña incisión en el cráneo a través de la cual, y guiada por una corona de estereotaxia que se le coloca al paciente, se introduce la aguja para realizar con exactitud la toma de una muestra en una localización tumoral determinada previamente en las técnicas de imagen realizadas.
- Biopsia con cirugía abierta: se toma durante el mismo acto de la cirugía y en ocasiones se analiza la muestra durante el mismo acto quirúrgico. En raras ocasiones, no es posible extraer una muestra del tejido tumoral bien por la localización del tumor o por el estado del paciente que no lo permite.
Pruebas de laboratorio: Estudio de marcadores (Ver Factores Pronósticos).
Tipos Histológicos (variedades de tumores cerebrales)
Denominamos tipos histológicos a las diferentes variedades de tumores cerebrales. La última clasificación es del año 2021 y, además de aspectos morfológicos, incluye características moleculares. Esta diferenciación entre las múltiples variedades de tumores cerebrales las llevamos a cabo basándonos en dos aspectos esenciales: el tipo de célula a partir de la cual se origina el tumor y el grado histológico que define el comportamiento biológico (agresividad) del tumor. Este último va desde el grado I (tumores menos agresivos) hasta el grado IV (tumores de comportamiento muy agresivo).
La clasificación de los tumores cerebrales contempla siete apartados, en los que se incluyen múltiples variedades diferentes de tumores, lo que muestra la gran complejidad diagnóstica de los mismos. Los tumores cerebrales reciben el nombre en función de la célula en la que se originan, siendo los más frecuentes los denominados astrocitomas que se dividen en 4 grados reflejando diferentes evoluciones.
Revisamos a continuación de forma resumida los principales tumores cerebrales en el adulto.
Astrocitomas
Los Astrocitomas se denominan así porque nacen de células llamadas astrocitos. En función de su comportamiento los clasificamos en 4 grados de acuerdo con la escala de la Organización Mundial de la Salud (OMS). Los Astrocitomas grado I incluyen al denominado Astrocitoma Pilocítico que en general pueden curarse con la cirugía. Representan un 5% de todos los gliomas y son más frecuentes en personas jóvenes.
El Astrocitoma Anaplásico es ya un tumor de grado III es decir con un comportamiento más agresivo. Se presenta más en hombres. En general el primer tratamiento es la cirugía lo que permite mejorar al paciente de los síntomas producidos por el tumor. En ocasiones no pueden ser operados debido a su localización y solo podemos hacer una biopsia del tumor es decir quitar una mínima parte del mismo que nos permitirá establecer el diagnóstico. Son tumores de naturaleza infiltrante lo que hace difícil el que puedan ser resecados en su totalidad. La radioterapia ha sido siempre el tratamiento estándar después de la cirugía pero hoy en día disponemos de resultados de estudios que muestran que la quimioterapia con temozolamida o con un esquema que denominamos PCV podría ser una alternativa. Su oncólogo médico en consenso con los demás especialistas implicados en el tratamiento de los tumores cerebrales le aconsejará sobre el mejor tratamiento.
Craneofaringioma
Se trata de un tumor benigno y poco frecuente (3–5%). Suelen presentarse cerca de la glándula pituitaria y pueden afectar diferentes partes. La cirugía es el tratamiento de elección.
Ependimoma
Constituyen el 1–2% del total de tumores cerebrales primarios y el 5–6% de todos los gliomas. En general se localizan cerca o dentro del sistema ventricular. Se dividen en 4 tipos y grados: subependimomas (grado I), ependimoma mixopapilar y ependimoma (grado II) y ependimoma anaplásico (grado III). La cirugía es el tratamiento de elección con el objetivo de conseguir la máxima reducción posible que como con todos los tumores cerebrales dependerá principalmente de la localización del mismo. La radioterapia se suele recomendar sobre todo cuando la cirugía no ha podido ser completa o a veces incluso si lo ha sido. La quimioterapia ha sido poco estudiada en estos tumores con pobres resultados y restringida a los ependimomas anaplásicos recidivados.
Germinales
Son también poco frecuentes (1–3%) y se presentan sobre todo en adultos jóvenes. Se subdividen en varios tipos: Germinoma, Teratoma, Carcinoma Embrionario, Seno Endodérmico y Coriocarcinoma. Es necesaria la realización de una punción lumbar dada la posibilidad de afectación del líquido cefalorraquídeo (LCR) en estos tumores. Pueden diagnosticarse también mediante la determinación en sangre y en el LCR de marcadores tumorales: la Alfafetoproteina (AFP), Fosfatasa Alcalina Placentaria (FAP) y la Gonadotropina Coriónica Humana (HCG). También son útiles para el seguimiento posterior. El tratamiento de elección de estos tumores es la quimioterapia o una combinación de esta con la radioterapia.
Glioblastoma (GB)
El GB representa un 15-17% de todos los tumores cerebrales primarios y es el más frecuente (50–75%) de los astrocitomas que es como se denomina al grupo de tumores cerebrales en el que se incluye al GB. Su incidencia se incrementa con la edad como ocurre en otros tumores. Son tumores de crecimiento rápido y por lo tanto producen síntomas secundarios al incremento de la presión intracraneal y que dependerán de la localización del tumor.
El diagnóstico se lleva a cabo fundamentalmente con la Resonancia y con la muestra tumoral obtenida o bien mediante una biopsia o bien mediante la cirugía del tumor. Se trata de un tumor de gran agresividad y de características muy particulares como por ejemplo la presencia de necrosis en sus células o la presencia de muchos vasos es decir un tumor muy vascularizado lo que le permite alimentarse y crecer. Otra característica de importancia es que tienen una elevada capacidad de infiltrar el tejido sano cerebral lo que limita su resecabilidad quirúrgica de forma completa.
La inmensa mayoría de los GB son primarios es decir aparecen como tales y crecen siendo la variedad más agresiva mietras que un pequeño porcentaje (<10%) son el resultado de una lenta transformación a partir de otros tumores cerebrales de bajo grado que con el tiempo se convierten en GB de alto grado. Avances recientes en biología molecular están ayudando a conocer mejor estas dos entidades y pueden ayudarnos no solo a diagnosticarlos mejor sino también a tratarlos mejor.
El tratamiento inicial del GB es la cirugía en la gran mayoría de los casos pero en un 20 a 30% de los casos solo será posible hacer una biopsia por encontrarse el tumor en un área en la que no es posible intervenir. La cirugía permitirá de una parte obtener el máximo material tumoral para llevar a cabo el diagnóstico, la máxima resección posible aspecto este muy difícil en muchas ocasiones por el carácter infiltrante del GB y el alivio de los diferentes síntomas que padece el paciente como consecuencia del tumor cerebral.
Una vez efectuado el diagnóstico y por lo tanto una cirugía completa o no, el tratamiento posterior en la mayoría de las veces combina la administración conjunta de quimioterapia y de radioterapia salvo en ocasiones en los pacientes ancianos. Una vez finalizada la administración conjunta de estas (quimio y radioterapia) se inicia un tratamiento solo con quimioterapia. La radioterapia se administra sobre la lesión con un margen alrededor durante unas semanas y se combina con un medicamento denominado temozolamida (quimioterapia). Nuevos medicamentos biológicos se encuentran en avanzado estado de investigación y podrían ser incorporados próximamente a este esquema. En ocasiones el neurocirujano puede depositar también durante el acto quirúrgico y tras haber resecado el tumor, unos sellos impregnados de quimioterapia con un fármaco que se denomina BCNU y que son absorbidos en el área en la cual se ha resecado el tumor.
Meduloblastoma
Se trata de un tumor poco frecuente en la edad adulta. Se localizan siempre en el cerebelo y son de crecimiento muy rápido y con capacidad de extenderse a otras partes del SNC. Dada su localización pueden ocasionar un bloqueo del LCR produciendo síntomas de aumento de la presión intracraneal como dolor de cabeza, vómitos, inestabilidad, etc. El tratamiento depende de la extensión del tumor y se basa en la máxima cirugía posible, la radioterapia y la quimioterapia.
Meningioma
Nacen de las capas de las meninges y son muy frecuentes (> 30%). La mayoría son benignos (grado I), no infiltrativos y de lento crecimiento. Pueden estar relacionados con alteraciones genéticas. Si el tumor se encuentra en un área en la que se puede intervenir, la cirugía es el tratamiento estándar. En algunos casos está indicada la radioterapia. El meningioma grado II tiene un comportamiento intermedio. El meningioma grado III es de comportamiento agresivo y la radioterapia está claramente indicada después de la cirugía. El papel de la quimioterapia está poco estudiado pero puede ser necesaria en los casos de recaídas.
Metastásicos
Como se comentó al inicio de este documento, cuando los tumores que nacen fuera del cerebro como por ejemplo en el pulmón presentan en algún momento de su evolución o incluso en el momento del diagnóstico metástasis en el cerebro, entonces se denominan tumores cerebrales secundarios o metastásicos. Los tumores que más frecuentemente pueden dar lugar a metástasis cerebrales son los de pulmón y mama aunque muchos otros pueden también hacerlo. El tratamiento de estos tumores metastásicos en el cerebro es en general el de la enfermedad que lo origina y la radioterapia cerebral.
Oligoastrocitomas
Son tumores muy poco frecuentes y que se componen en general de dos tipos histológicos diferentes (astrocitos y oligodendrocitos). Se clasifican también en grados. El tratamiento de los de alto grado (grado III o anaplásicos) se basa como en otros casos en la máxima cirugía posible seguida de radioterapia y quimioterapia pero no administrada esta de forma concomitante sino de forma secuencial pudiéndose administrar la quimioterapia antes o después de la radioterapia. El tipo de quimioterapia puede ser en estos tumores con temozolamida o con otro esquema denominado PCV. Nuevos avances en el conocimiento de la biología molecular de estos tumores permiten conocer mejor el comportamiento de los mismos y la sensibilidad mayor o menor a los tratamientos que se administran (Ver apartado siguiente: Oligodendrogliomas).
En los tumores de bajo grado (grado II) el tratamiento con radioterapia puede estar justificado administrarlo más adelante en su evolución y no inicialmente. El papel de la quimioterapia es más controvertido reservándose para aquellos casos más evolucionados.
Oligodendrogliomas
Son también tumores poco frecuentes y en este caso las células que los componen se denominan oligodendrocitos.
Como en el caso anterior se clasifican en grados denominando a los de grado II de bajo grado y a los de grado III anaplásicos. En estos tumores el síntoma inicial más frecuente es una convulsión. El tratamiento de los grados III (anaplásicos) y de los de bajo grado (grado II) es similar a lo comentado en el apartado anterior (oligoastrocitomas).
En estos tumores y en particular en los de grado III se han descrito unas alteraciones genéticas que han adquirido una gran relevancia en cuanto a información pronóstica y/o predictiva. Se ha descrito una alteración cromosómica que muestra que la pérdida combinada del brazo corto del cromosoma 1 y del brazo largo del cromosoma 19 se asocia con un mejor pronóstico de estos tumores. Otra alteración molecular que denominamos IDH1/2 y que vamos conociendo cada vez mejor está adquiriendo una importancia relevante para entender mejor el comportamiento de estos tumores y su evolución con los diferentes tratamientos tanto de radioterapia como de quimioterapia.
Factores Pronósticos
Un factor pronóstico es aquella información de la enfermedad que nos permite conocer cómo puede comportarse y valorar el tratamiento más adecuado.
Entre los factores pronósticos a considerar en los tumores cerebrales están los siguientes:
Tipo Histológico (tipo de tumor cerebral): Sabemos que no todos los tumores cerebrales se comportan igual por lo que algunos de ellos tienen un comportamiento menos agresivo que otros como por ejemplo el astrocitoma (grado II) en comparación con el astrocitoma anaplásico (grado III) o con el glioblastoma (grado IV).
Grado histológico: El grado histológico informa dentro de un mismo tipo histológico sobre el comportamiento del tumor. Por ello se han establecido cuatro grados (I a IV) siendo los tumores de grado III y IV los de comportamiento más agresivo y menor supervivencia. Los tumores de grado II son de comportamiento intermedio y pueden progresar a grado III o grado IV con el tiempo. Para definir el grado de un determinado tipo histológico de tumor cerebral consideramos diferentes características de las células que lo componen como la Atipia nuclear (alteraciones en el núcleo de la célula), la mitosis (capacidad de crecimiento), microproliferación vascular (aparición de nuevos vasos) o la necrosis (zonas del tumor con células muertas).
Alteraciones genéticas y moleculares: En estos últimos años asistimos a un cambio cada vez más relevante en este apartado. En efecto disponemos de más y nueva información que nos permite, sobre todo en los gliomas, individualizar cada vez más el tratamiento. Algunas características moleculares también conocidas como biomarcadores y que vamos conociendo mejor hacen que podamos saber con mayor certeza como se van a comportar (pronóstico) y/o como van a responder a los tratamientos (predictivo). Estos biomarcadores adoptan nombres de los genes (MGMT o IDH) implicados o bien de alteraciones descritas en los cromosomas (1p/19q). Esta información tiene ya hoy en día una aplicación directa en la clínica y permite adaptar mejor los tratamientos y por lo tanto la supervivencia de los pacientes.
Estado funcional: La capacidad del paciente para hacer una vida más o menos independiente en cuanto a sus actividades básicas de la vida diaria, es un importante factor pronóstico. Cuanto más independiente esté el paciente mejor será su estado funcional y ello conlleva un mejor pronóstico.
Edad: En adultos, cuanto más joven, en general, el pronóstico es más favorable.
Tumor residual tras la cirugía: En los tumores cerebrales es relativamente frecuente que por razones debidas a la localización del tumor, la cirugía no pueda llevarse a cabo por el alto riesgo de secuelas graves. En estos casos solo podemos hacer una biopsia del tumor por lo que siempre se queda enfermedad tumoral residual. Cuando esto ocurre el pronóstico es peor.
Extensión metastásica de la enfermedad: La extensión de los tumores cerebrales a otros órganos o a ganglios linfáticos es muy rara y excepcional salvo en algún tipo concreto como el meduloblastoma que cuando ocurre comporta un peor pronóstico.
Tratamiento
El paciente con un tumor cerebral debe ser sometido a una terapia específica, y a un tratamiento para el alivio de los síntomas: dolores de cabeza, crisis convulsivas, pérdida de funciones motoras, sensitivas, etc… El tratamiento específico consistirá en cirugía con o sin radioterapia, radioterapia si no es posible la cirugía y puede también estar indicada la quimioterapia, habitualmente en asociación a las otras formas de tratamiento.
Cirugía
Es una de las herramientas principales y en general la primera en utilizarse para el tratamiento de la mayoría de los tumores cerebrales. En algunos de ellos puede ser suficiente para controlar la enfermedad. Los objetivos principales de la cirugía son:
- Obtener tejido tumoral para poder realizar un diagnóstico histológico preciso es decir para saber ante qué tipo de tumor cerebral nos encontramos
- Realizar la máxima resección posible pero conservando la máxima función a la vez lo que en muchas ocasiones da lugar a que la cirugía de los tumores cerebrales no permita una resección completa del tumor.
- La cirugía permite también descomprimir los tejidos sanos lo que conlleva una importante mejora de los síntomas que presentan los pacientes mejorando su funcionalidad y su calidad de vida.
En diferentes estudios se ha podido demostrar claramente que cuando la resección del tumor cerebral es completa el pronóstico mejora significativamente en relación a cuando solo se puede hacer una biopsia como ocurre en pacientes en los que el tumor está cercano a zonas que rigen funciones críticas y la resección no es posible.
La cirugía es siempre de gran complejidad pero cuenta hoy en día con nuevas tecnologías que permiten en gran medida resecciones más completas con menor riesgo de secuelas. Entre las diferentes técnicas se encuentran:
- La estereotaxia que permite localizar el tumor mediante un sistema geométrico que nos sitúa el punto más adecuado para la biopsia.
- Los sistemas de neuronavegación que son instrumentos informáticos que fusionan las imágenes radiológicas durante la intervención para una mejor definición de la extensión del tumor en quirófano.
- El mapeo funcional cortical intraoperatorio. Se trata de un sistema que permite localizar áreas elocuentes y así evitar el daño de esas zonas durante la intervención.
- La Fluorescencia que permite al neurocirujano conocer mejor durante la intervención la zona en donde se encuentra el tumor.
En algunos tumores cerebrales tras la cirugía, se realizará de forma precoz (menos de 72 horas) una resonancia que nos permitirá conocer el resultado de la misma y a la vez nos servirá de base para ver la evolución del tumor y el efecto de los diferentes tratamientos posteriores.
Otras técnicas diagnósticas como la tomografía por emisión de protón único con Talio 201 (SPECT-Talio 201), la resonancia con espectroscopia o la tomografía por emisión de positrones (PET), pueden ayudarnos a aclarar la existencia o no de enfermedad residual.
La cirugía puede llevar asociada un incremento del riesgo de complicaciones como empeoramiento de los síntomas neurológicos, convulsiones, infecciones, hemorragias, pérdida de líquido cefalorraquídeo y otras de carácter más general, como pueden ser episodios trombóticos, infarto, hemorragia digestiva, etc.
Radioterapia
Es otra herramienta fundamental para el tratamiento de los tumores cerebrales. Consiste en el envío de partículas ionizadas de alta energía contra las células del tumor. El objetivo es producir daños en su material genético que facilitará la muerte celular del tumor. Esta forma de tratamiento se realiza por médicos especialistas en oncología radioterápica.
La radioterapia puede dañar también el tejido que rodea al tumor y para minimizar este efecto se fracciona la dosis total a administrar a lo largo de varios días o semanas. Los oncólogos radioterápicos, con la ayuda de los radiofísicos establecen sobre una tomografía axial computarizada (TAC), una resonancia y/o sobre una PET, la localización del tumor, para definir el área que debe ser irradiada. Es lo que se conoce como planificación del tratamiento.
La radioterapia puede aplicarse mediante distintas técnicas; cada una de ellas puede tener diferentes indicaciones según la extensión de la irradiación y el tipo tumoral. La dosis que se necesita alcanzar para el control de la enfermedad depende de la naturaleza del tumor y de la localización.
La radioterapia tiene un papel fundamental también en aquellos pacientes con metástasis cerebrales, con gliomas de alto grado y con tumores irresecables. En los tumores de bajo grado puede ser conveniente esperar a una evolución más tardía para administrarla. La indicación de la misma se decidirá por parte del oncólogo radioterapeuta en el seno de un comité multidisciplinar.
Existen diversas modalidades de administración de radioterapia:
Radioterapia externa convencional: Utiliza distintos haces de irradiación externa para irradiar el volumen tumoral y minimizar la cantidad de tejido sano circundante irradiado, y con ello, la toxicidad. El tratamiento es administrado, durante varios días o semanas, recibiendo dosis diarias iguales. Durante el tratamiento el paciente es inmovilizado con una máscara para asegurar los puntos de irradiación durante todo el tratamiento.
Radioterapia externa estereotáxica: Es una irradiación externa en la que el volumen de irradiación es pequeño y sobre él que se alcanzan dosis más altas en una sola sesión. El campo de irradiación se determina mediante un sistema de ejes de coordenadas colocado en el paciente, que permite localizar con precisión el punto de irradiación. Es precisa la utilización de una maquinaria específica como puede ser el acelerador lineal, o un gammaknife (una unidad de cobalto modificada para un tratamiento multiplanar) o un ciberknife (con sistema robótico que permite delimitar mejor el área de irradiación). Puede ser útil en pacientes con metástasis cerebrales y en algunos casos de tumores cerebrales seleccionados.
Radioterapia intersticial o braquiterapia: Consiste en implantar sobre el área tumoral, catéteres como fuentes de irradiación (por ejemplo, agujas de iridio192, etc) que alcanzan dosis terapéuticas alrededor de dicha área evitando la irradiación del tejido sano a distancia. Estas técnicas son altamente especializadas y pueden ser utilizadas en el tratamiento de los tumores cerebrales.
Terapia con haces de partículas: Se utilizan unas partículas llamadas protones o neutrones en centros muy especializados, puesto que es preciso un ciclotrón para generarlas. La principal ventaja de estas técnicas es la posibilidad de circunscribir de forma más precisa el área de irradiación. Aunque se han utilizado para algunos tipos especiales de tumores, están por definir sus indicaciones y sus ventajas frente a las formas de tratamiento convencional.
Radioterapia externa hiperfraccionada: Es una forma de radioterapia externa en la que con un mayor número de fracciones y dosis por día, se pretende aumentar la capacidad de destrucción del tejido tumoral. Puede ser estereotáxica, si se quiere irradiar un pequeño volumen pudiendo ser de utilidad en casos seleccionados.
Radioterapia de intensidad modulada: Es un sistema por el cual se consigue dar dosis más altas en unas áreas del tumor y dosis más bajas en otras áreas; el objetivo es alcanzar las dosis adecuadas en todos los tejidos tumorales, con la menor toxicidad de los tejidos circundantes. Se van conociendo en función de estudios recientes, aquellas localizaciones donde puede mejorar los resultados de la radioterapia externa convencional.
Protonterapia: es un tipo de radiación que permite tratar los tumores con la misma eficacia pero con menos toxicidad debido a que afecta menso a los tejidos sanos circundantes al tumor.
La radioterapia puede tener efectos secundarios que serán diferentes dependiendo del momento en el que se produzcan:
Agudos: Aparecen horas o días tras el inicio del tratamiento y son transitorios; consisten generalmente en dolor de cabeza o empeoramiento de los síntomas neurológicos. Estos efectos son producidos por aumento del edema asociado al tumor y pueden ser tratados con esteroides.
Toxicidades diferidas tempranas: Pueden aparecer desde seis semanas hasta seis meses después de finalizar la radioterapia. Son producidas por un daño neurológico reversible y causan empeoramiento de los síntomas neurológicos, tratándose también con esteroides. Clínicamente pueden ser similares a los cambios que se producen en el paciente cuando está aumentando el tamaño del tumor y en estos casos, pueden ser precisos estudios radiológicos y tratamiento médico.
Toxicidades tardías: Pueden aparecer años después de finalizar la radioterapia y se producen por destrucción o muerte celular del tejido cerebral (radionecrosis); los síntomas son también similares a los que produce el crecimiento tumoral precisando como en el caso anterior un diagnóstico preciso y un tratamiento.
Otro efecto indeseable tardío es el daño cognitivo que puede oscilar entre un ligero daño neurológico y una auténtica demencia. También aunque muy poco frecuente pueden aparecer tumores radioinducidos u otras toxicidades como la pérdida de la agudeza visual o déficits hormonales.
Quimioterapia
De forma histórica, denominamos quimioterapia al conjunto de medicamentos que utilizamos para el tratamiento específico del cáncer. Hoy en día este término quizás no sea el más apropiado puesto que existen nuevos medicamentos contra el cáncer que no son quimioterapia como tales y que denominamos biológicos por haber sido desarrollados a partir de nuevos conocimientos a nivel molecular y con mecanismos de acción diferentes y más selectivos en general que la quimioterapia. A diferencia de los medicamentos clásicos considerados como quimioterápicos, los biológicos son fármacos que en general aunque no siempre, tienen una diana que podemos determinar y contra la que van dirigidos. De alguna forma constituyen una nueva y creciente familia de medicamentos que conforman la denominada medicina personalizada. En muchos tumores y por ende los tumores cerebrales utilizamos hoy en día esquemas de tratamiento que combinan tanto quimioterapia como medicamento biológico al haber demostrado estos que mejoran en muchos casos los resultados obtenidos previamente con la quimioterapia sola.
Tanto la quimioterapia como los biológicos pueden según cuales ser administrados por vía oral, intravenosa o local y tienen la capacidad de difundirse por todo el organismo por lo que pueden actuar en diferentes órganos. El objetivo principal es el de destruir las células tumorales. En el caso de los tumores cerebrales existen dos importantes dificultades históricas en cuanto al tratamiento con fármacos que son la existencia de una barrera natural denominada hematoencefálica (BHE) que protege al sistema nervioso central de la llegada de sustancias tóxicas por la sangre y la resistencia histórica de estos tumores al tratamiento antitumoral.
Sin embargo, la situación actual ha experimentado un cambio muy importante pues disponemos de nuevos medicamentos (quimioterapia y biológicos) que están mejorando la eficacia de forma significativa.
En general, el tratamiento de los tumores cerebrales con medicamentos se administra después de la cirugía y asociado o no a la radioterapia según sea un tipo de tumor u otro. En ocasiones también se administra antes de la cirugía con el objetivo de reducir el tamaño del tumor o porque la cirugía no puede llevarse a cabo. En el glioblastoma que constituye el tumor cerebral de alto grado más frecuente, la quimioterapia con temozolamida ha demostrado un claro beneficio y constituye hoy en día el estándar de tratamiento asociado a la radioterapia tras la cirugía. Investigaciones en curso tratan de mejorar los resultados actuales y podrían modificar próximamente el estándar actual.
En otros tumores de alto grado como los denominados oligodendrogliomas o los oligoastrocitomas anaplásicos, la quimioterapia con un esquema denominado PCV constituye también un estándar de tratamiento siendo estos tumores más sensibles a la quimioterapia que el glioblastoma. Otros tumores cerebrales poco frecuentes como el meduloblastoma o el linfoma del SNC, o los tumores germinales del SNC son también sensibles a la quimioterapia y esta forma parte del tratamiento. La actividad de la quimioterapia en otros tumores cerebrales es marginal y se encuentra en evaluación en diferentes ensayos clínicos.
Otra aplicación de la quimioterapia puede ser a nivel local, es decir en el lecho dejado por el cirujano tras la extirpación del tumor durante la intervención habiendo demostrado también un beneficio en supervivencia asociado a la radioterapia posterior a la cirugía. Este efecto favorable se ha visto tanto en pacientes que son operados de una recaída como en aquellos sometidos a cirugía completa tras el diagnóstico inicial.
Tanto la quimioterapia como las terapias biológicas presentan efectos secundarios y por ello es muy importante conocerlos para poder prevenirlos y aminorar sus efectos. En este sentido siempre que se administran estos tratamientos es imprescindible escuchar bien los consejos del oncólogo médico. Los efectos pueden ser variables según los medicamentos empleados. Pueden producir náuseas, vómitos, cansancio, pérdida de apetito, leucopenia (disminución del número de glóbulos blancos, que se relaciona con las defensas y la susceptibilidad a padecer infecciones), anemia, plaquetopenia (disminución del número de plaquetas, que puede producir hemorragias), etc…. En el caso de las terapias biológicas los efectos secundarios suelen ser específicos de los mismos y variar con respecto a los de la quimioterapia.
Su oncólogo médico le informará de la toxicidad esperable con el tratamiento y la dosis empleada, así como de las medidas a tomar para su alivio.
Seguimiento
Denominamos seguimiento al periodo de tiempo que transcurre una vez finalizado el tratamiento activo es decir quirúrgico y/o radioterápico y/o sistémico. En algunos tumores cerebrales es posible que el tratamiento sistémico (con quimioterapia o biológicos) sea prolongado y no pueda suspenderse.
El objetivo del seguimiento es conocer cuál es la situación de la enfermedad y cuales son en su caso las secuelas del tratamiento y/o de la enfermedad. La duración del seguimiento es en muchas ocasiones muy larga en el tiempo.
Dependiendo del tipo de tumor, su médico le aconsejará sobre los intervalos de tiempo en los que tiene que acudir a una revisión y también sobre las pruebas radiológicas o de análisis u otras que tiene que hacer previamente a la consulta.
No existen recomendaciones concretas en cuanto a la periodicidad de las revisiones, pero dependerá del tipo de tumor, de los resultados del tratamiento efectuado y de las posibles secuelas. El seguimiento conllevará controles radiológicos periódicos, realizados con la resonancia magnética. Puede ser necesaria la realización de estudios analíticos sobre todo en aquellos pacientes con tratamiento anticonvulsivante que requieran un control de sus niveles en sangre.
Recaídas
Algunos tipos de tumores cerebrales sobre todo los denominados gliomas tienen elevada tendencia a reproducirse una vez finalizado el tratamiento o incluso durante el mismo. La recaída de un tumor cerebral puede ocurrir entre meses y años después según el tipo de tumor. En caso de recaída, el paciente deberá ser evaluado por un equipo multidisciplinar es decir por los diferentes especialistas implicados en el diagnóstico y en el tratamiento de los tumores cerebrales. Se plantearán las diferentes opciones que pueden ser en ocasiones quirúrgicas de nuevo y/o radioterápicas y/o sistémicas en función de cada caso y de cada tumor.
En ocasiones y en particular en los glioblastomas puede producirse un efecto que denominamos pseudoprogresión que como su propio nombre indica se trata de una falsa progresión de la enfermedad. Este fenómeno se produce principalmente en los primeros meses siguientes a la radioterapia y puede parecerse clínicamente y radiológicamente a una progresión de la enfermedad sin serlo. En estos casos su oncólogo le informará sobre este fenómeno y le aconsejará sobre la actitud y pruebas a seguir.
En otras ocasiones pueden presentarse complicaciones tardías del tratamiento que no obligatoriamente significan una recaída de la enfermedad y utilizaremos diferentes estrategias para diferenciarlo.
Algunas preguntas de interés que podrá hacerle a su equipo médico
- ¿En qué parte del cerebro tengo el tumor?
- ¿Cómo se llama mi tumor y de qué grado es? ¿Cuáles son los síntomas más relevantes?
- ¿Qué tipo de tratamientos tengo que hacer y qué riesgos conllevan?
- ¿Cuáles son los beneficios esperados con el tratamiento?
- ¿Qué pruebas diagnósticas tengo que hacer?
- ¿Existen alternativas de tratamientos experimentales?
- ¿Puedo hacer los tratamientos en mi hospital?
-¿Cómo puede afectar a mi vida diaria? ¿Puedo hacer determinadas actividades como trabajar, ejercicio, conducir, bañarme en la playa o piscina, etc.?
-¿Qué medicación debo tomar y qué efectos secundarios tiene?
-¿Qué seguimiento tengo que llevar a cabo?
Links nacionales de interés
- Grupo Español de Investigación en Neuro-Oncología (GEINO): www.geino.es
- Asociación de Afectados por Tumores Cerebrales en España (ASATE): www.asate.es