Cáncer de tiroides
Índice de navegación
AUTORES: Anabel Ballesteros y Enrique Grande
El tiroides es una glándula localizada en la parte anterior del cuello, por delante de la laringe, con forma de mariposa y formada por dos lóbulos unidos en el centro por un istmo.
Normalmente, en una persona sana, el tiroides no se palpa. (Fig. 1)
Fig 1. Tiroides
La función del tiroides es la de producir las hormonas tiroideas que intervienen en el metabolismo de múltiples de las funciones del organismo. Se producen tres tipos de hormonas distintas: la T3, la T4 y la calcitonina. Para ello se necesita de Yodo (I) que debe ser aportado a nuestro cuerpo desde el exterior a través de los alimentos o mediante suplementos.
El yodo se encuentra en el agua de mar, las algas y en los vegetales. Una dieta variada y rica en frutas y verduras suele incluir la cantidad necesaria de yodo para un correcto funcionamiento del tiroides.
Existen algunas zonas geográficas en el mundo y en España en las que el yodo aportado en la dieta o a través del agua es insuficiente, como sería en la zona de las Hurdes, produciéndose aumento del tamaño del tiroides (bocio) endémico en más población de la normalmente esperada.
Los tumores más frecuentes que surgen de la glándula tiroidea se derivan de la proliferación anómala de dos tipos de células fundamentalmente:
- Células foliculares: que son las que producen las hormonas tiroideas T3 y T4, y que se caracterizan por liberar una proteína característica llamada Estas células foliculares son las responsables de los tumores más frecuentes que asientan en esta glándula, que serían los tumores diferenciados de tiroides, así como de los más agresivos que se corresponderían con los tumores anaplásicos.
- Células C o parafoliculares: que son las productoras de calcitonina y que dan lugar a los carcinomas medulares de tiroides.
Epidemiología
El cáncer de tiroides es un tumor relativamente poco frecuente, que en el año 2022 se estima que será diagnosticado en 6.040 pacientes en España de los que aproximadamente ¾ de los pacientes serán mujeres (4.640) y ¼ hombres (1.400). (Las cifras del Cáncer en España 2022).
El cáncer de tiroides supone la neoplasia endocrina más frecuente (90 % de todas las neoplasias endocrinas), y la principal causa de muertes de todos los tumores endocrinos incluidos los tumores neuroendocrinos, los feocromocitomas, paragangliomas, y tumores de la glándula hipofisaria entre otros.
Su diagnóstico se suele realizar en la edad media de la vida, dependiendo de los distintos subtipos histológicos. La incidencia de este tumor ha aumentado en los últimos años probablemente debido al aumento de las pruebas de imagen que se realizan a la población en general por cualquier otro motivo, pero la mortalidad se ha mantenido estable.
Factores de riesgo
La causa del cáncer de tiroides no se conoce; la mayoría de las personas diagnosticadas no tienen ningún factor de riesgo conocido. Sin embargo, existen algunas circunstancias en las que se ha visto una frecuencia más elevada.
Las más importantes son:
-
Exposición a radiaciones ionizantes: es el factor etiológico más reconocido, especialmente si la exposición tiene lugar en la infancia. Se ha observado tras la exposición con fines terapéuticos (radioterapia) o por cercanía de fuentes radiactivas exógenas medioambientales (accidentes nucleares). Las personas que han recibido radioterapia en la cabeza o en el cuello, incluso décadas antes, tienen un riesgo aumentado de cáncer de tiroides hasta 50 veces superior al de la población general. Esto se suele ver en algunas pacientes curadas de cáncer de mama o de linfomas tratadas años antes con radioterapia.
-
Factores genéticos: existe un tipo de cáncer de tiroides, el carcinoma medular, que presenta una forma familiar en un 25 % de los casos. No obstante, este es el tipo más raro de cáncer de tiroides. El carcinoma papilar puede ser también una manifestación de varios síndromes hereditarios como son el síndrome de Gardner, la enfermedad de Cowden o la neoplasia endocrina múltiple que afectarían aproximadamente al 10% de los tumores diferenciados de tiroides.
-
Dieta baja en Yodo: se relaciona con los tumores papilares y foliculares.
-
Sexo y edad: son más frecuentes en mujeres con edades comprendidas entre 30 y 50 años. Esta asociación con el sexo femenino pudiera deberse a una mayor exposición a estrógenos (como pudiera ser el uso de anticonceptivos orales).
Manifestaciones clínicas
La mayoría de los tumores de tiroides no suele dar ningún síntoma, al menos en sus etapas más localizadas, pero en procesos avanzados se puede asociar a síntomas como dificultad para tragar, dolor en la parte anterior del cuello o ronquera por afectación indirecta de las cuerdas vocales. El síntoma más frecuente, cuando aparece, del cáncer de tiroides es la aparición de un bulto en la parte anterior del cuello, que puede ser visible o palpable.
No obstante, la mayoría de los nódulos tiroideos que crecen y se palpan son benignos. La manera de diferenciar si la lesión tiroidea se corresponde con un quiste o un tumor sería a través de una punción y de su análisis del contenido de células de la lesión.
Diagnóstico
La sospecha de un cáncer de tiroides comienza con el hallazgo de un nódulo en el tiroides. La mayoría de estos nódulos son benignos y no corresponden a patología tumoral; algunos no requieren salvo seguimiento estrecho.
En aquellos casos en los que exista sospecha de cáncer de tiroides se debe plantear el realizar:
1. Ecografía tiroidea: es la prueba más sencilla y accesible para el estudio del tiroides. Supone una exploración indolora y rápida que permite medir el tamaño del tiroides, el número de nódulos que contiene, el tamaño de éstos y la composición de los mismos. También nos permite ver si existe alguna estructura más afectada en el cuello como pueden ser los ganglios. Sirve de utilidad para orientar sobre la necesidad de realizar o no más pruebas.
2. Análisis de sangre: se miden los niveles de hormonas tiroideas (T3, T4 y TSH) y de los marcadores tumorales como la tiroglobulina, la calcitonina o el antígeno carcinoembrionario (CEA). Tanto la tiroglobulina como la calcitonina son bastante específicas y sensibles de alteraciones tiroideas y se suelen correlacionar con volumen o cantidad anómala de células tiroides, por lo que nos pueden poner en sobre aviso de la existencia de un tumor. De igual modo, estos marcadores tumorales nos son de utilidad para evaluar la respuesta a los tratamientos de estos tumores del tiroides así como para el seguimiento a largo plazo de los mismos.
3. Punción-aspiración con aguja fina (PAAF): una vez que tenemos un nódulo tiroideo identificado con ecografía, debemos analizarlo. Esta técnica consiste en la obtención de células a través de una aguja muy fina mediante aspiración para después observarlas al microscopio. Es una técnica poco dolorosa y rápida de realizar, con muy pocos efectos secundarios. Su precisión diagnóstica es del 90 % para las lesiones benignas y del 60-80 % para las malignas. En ocasiones el resultado puede ser no concluyente por lo que puede ser necesario repetirla.
4. Biopsia: algunas veces, las células que se obtienen por punción no son suficientes o definitivas para el diagnóstico y es necesaria una muestra más grande que consiste en la extirpación de la zona sospechosa para su posterior análisis. Es un procedimiento más complicado que requiere anestesia y produce más molestias por lo que únicamente se realiza en casos difíciles de diagnosticar mediante otras técnicas.
5. Gammagrafía tiroidea: es una prueba específica para el estudio de la patología tiroidea y mide su funcionamiento como glándula. Consiste en la administración de una sustancia radioactiva (generalmente Yodo-131) por vía oral o intravenosa. Permite la diferenciación entre nódulos no funcionantes, llamados “fríos” y los funcionantes o “calientes”: los nódulos “fríos” tienen mayor riesgo de malignidad. (Fig. 2).
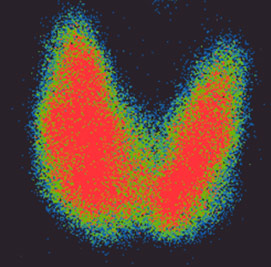
Fig. 2. Gammagrafía tiroidea
Una vez diagnosticado un cáncer de tiroides se puede el estudio de extensión con un TAC toraco-abdominal a valorar si con contraste yodado o no por el médico solicitante, una resonancia magnética, un PET con glucosa marcada e aquellos pacientes en los que se sospeche una histología agresiva o, en aquellos pacientes con dolores óseos se realiza una gammagrafía ósea que permite descartar metástasis óseas.
Tipos histológicos
Hay cuatro tipos fundamentales de cáncer de tiroides que se comportan de forma diferente:
1. Carcinoma papilar de tiroides: es el tipo más frecuente, representa entre el 80 y el 90 % de los casos. Se origina a partir de las células foliculares del tiroides. Se presenta como un nódulo tiroideo solitario, aunque en 35-45 % de los casos se puede asociar a metástasis de los ganglios linfáticos. Su incidencia es mayor en la mujer y en pacientes con antecedentes de irradiación cervical. Sólo en fases avanzadas, después de años de evolución, suele producirse invasión de estructuras vecinas y metástasis a distancia, siendo muy rara su diseminación por la sangre (generalmente a los pulmones).
2. Carcinoma folicular de tiroides: representa entre el 5 y el 10 % de los tumores de tiroides, su comportamiento es más agresivo que el del carcinoma papilar, pudiendo metastatizar hasta en el 30 % de los casos. Es también más frecuente en mujeres (2-3:1). La edad de aparición es un poco más alta siendo típico de lugares donde existe bocio endémico. Con frecuencia es difícil de distinguir sus células de las del tiroides normal y sólo una vez que se ha extirpado la mitad del tiroides y se ha analizado, se puede saber con certeza que es un tumor maligno y en ocasiones es necesario reintervenir para quitar todo el tiroides. Clínicamente se presenta de forma similar al papilar como un nódulo tiroideo indoloro sobre una glándula sana o sobre un bocio multinodular.
3. Carcinoma medular de tiroides: supone alrededor del 5 % de los tumores de tiroides. Es un tumor neuroendocrino que deriva de las células C o parafoliculares, productoras de calcitonina. Esta hormona se encarga de la regulación de los niveles de calcio en sangre. El 80 % son esporádicos, sin embargo, un 20 % de los tumores de este tipo se asocian a un síndrome hereditario que se asocia a otros tumores endocrinos (Neoplasia Endocrina Múltiple o MEN 2). Los casos esporádicos suelen presentarse en la quinta-sexta década de la vida con un discreto predominio femenino. Su forma de presentación más común es como nódulo solitario tiroideo. En la mayoría de los pacientes con CMT, la enfermedad ya se ha diseminado en el momento del diagnóstico. El 50 % de los casos presenta signos clínicos de afectación linfática cervical y el 5 % presenta enfermedad diseminada multifocal. Los síntomas son causados por la secreción de calcitonina y otras sustancias. Esto puede provocar diarrea, flushing (enrojecimiento facial) y en ocasiones puede producir un cuadro endocrino más complejo denominado síndrome carcinoide.
4. Carcinoma anaplásico de tiroides: es el subtipo más raro y el de peor pronóstico y rápida evolución. Es el más agresivo de todos los tumores tiroideos. Ocurre con una frecuencia del 1-2 % de todas las neoplasias tiroideas y menos del 10 % de los pacientes tratados sobreviven más allá de un año. Aparece normalmente entre la séptima y la octava década de la vida. Clínicamente se caracteriza por una masa en la región anterior del cuello de rápido crecimiento acompañado de síntomas de compresión de las vías digestivas y aéreas superiores produciendo dolor cervical, disfonía y disfagia por invasión tumoral difusa de estas estructuras. Esta invasión limita el papel de la cirugía que suele ser paliativa, reductora de masa y casi nunca radical. Se considera estadio IV (avanzado) desde el diagnóstico basado en su histología y comportamiento biológico. Poseen capacidad de diseminación por todas las vías, estando presentes metástasis ganglionares cervicales y metástasis a distancia entre el 18 y 50 % de los casos al diagnóstico. Las localizaciones metastásicas más frecuentes son los pulmones (90 %), el hueso (15 %) y el cerebro (15 %). Son características las metástasis cutáneas, apareciendo frecuentemente en el cuero cabelludo. Es un tumor con nula o escasa respuesta al tratamiento, pero en aquellos pacientes en los que sea posible la resección quirúrgica se debe realizar (tiroidectomía total y linfadenectomía).
Estadios del tumor
El sistema más utilizado para su clasificación se llama TNM.
• T hace referencia al tamaño tumoral,
• N al estado de los ganglios.
• y M a la presencia de metástasis a distancia. Según esta clasificación se establecen cuatro estadios (I, II, III y IV) en el que el I supone un tumor localizado en la glándula y el IV implica metástasis a distancia.

Pronóstico
La supervivencia global a cinco años está en torno a 96,9 %, siendo 99,7 % para estadios localizados y de 57,8 % para estadios avanzados; esta puede variar en función de varios factores:
1. Tipo histológico: la supervivencia de los carcinomas papilares a los 10 años está entre el 80 y 95 %, mientras que en los foliculares oscila entre el 65 y 85 %. Sin embargo, rara vez se consiguen supervivencias a más de 2 años en los carcinomas medulares y anaplásicos.
2. Edad: es el factor más importante en los carcinomas diferenciados, ya que por debajo de los 40 años son pocos los pacientes que fallecen a consecuencia del tumor pero a partir de los 50 años la curva de supervivencia desciende bruscamente.
3. Sexo: no parece tener mucha relevancia aunque la mortalidad global es discretamente más elevada en varones.
4. Estadio local: su influencia es muy importante, ya que la mortalidad de los tumores menores de 2 cm es prácticamente nula, y aumenta progresivamente según exista afectación de la cápsula ganglionar.
5. Metástasis a distancia: Se ve influenciada principalmente por la agresividad biológica ligada a la histología de cada uno de estos tumores de tiroides y por la edad. De este modo, no es infrecuente supervivencias mayores de 10 años en pacientes menores de 40 años, exceptuando los tumores medulares y anaplásicos.
Tratamiento
Hay varias modalidades de tratamiento que se pueden aplicar en el cáncer de tiroides dependiendo del tipo de tumor y la fase de la enfermedad.
Se distinguen fundamentalmente dos escenarios:
A. Tratamiento de la enfermedad localizada
1. Cirugía: Es el principal tratamiento para el cáncer de tiroides. Es importante realizar un estudio de extensión previo para planear el procedimiento quirúrgico a realizar.
Según la extensión, son varias las técnicas que se pueden realizar:
- Hemitiroidectomía o extirpación de un lóbulo: se puede indicar en casos unilaterales o con factores de buen pronóstico.
- La tiroidectomía total o extirpación completa del tiroides: es el tratamiento indicado en la mayoría de los casos, especialmente ante la presencia de factores de mal pronóstico (tamaño > 4 cm, extensión extratiroidea, bilateralidad, edad > 45 años, presencia de metástasis ganglionares).
- En ocasiones puede ser necesaria la cirugía de los ganglios del cuello (disección cervical). Puede considerarse en caso de nódulos cervicales palpables y con biopsia positiva. En los casos en los que no existen nódulos palpables, su indicación está cuestionada. Está indicada de entrada en los carcinomas medulares de tiroides.
Las complicaciones más frecuentes de la cirugía son:
- Hipotiroidismo: al extirparse la glándula tiroides en su totalidad, la secreción de hormonas tiroideas por la glándula queda anulada. El tratamiento consiste en suplementarlas a través de pastillas que se requerirían de forma permanente.
- Parálisis de cuerdas vocales: los nervios recurrentes son los encargados de mover las cuerdas vocales y pasan muy cerca del tiroides. En los tumores puede estar afectado por invasión o lesionarse en la cirugía. Cuando afecta a un único lado, su síntoma es la ronquera y la dificultad para respirar con el ejercicio extremo. Puede mejorar parcialmente con rehabilitación.
- Hipoparatiroidismo: las glándulas paratiroides en número de cuatro se encuentran alojadas dentro del tejido tiroideo. En algunas cirugías se pueden extirpar de forma accidental ocasionando un déficit de hormona paratiroides, que se debe aportar de forma continua.
Tras el tratamiento quirúrgico inicial, los pacientes son típicamente manejados por los especialistas en endocrinología. Se debe valorar el riego de enfermedad recurrente o metastásica para determinar la necesidad de tratamiento posterior adyuvante, especialmente tratamiento con radioyodo. Este tratamiento adyuvante con radioyodo pretendería eliminar restos tiroideos que pudieran quedar tras la cirugía tanto en el propio lecho tiroideo como en ganglios adyacentes que pudieran albergar en su interior alguna célula tumoral que pudiera haber escapado del tumor principal.
2. Tratamiento con yodo radiactivo (I-131): Desde el punto de vista terapéutico, se aprovecha que el tiroides absorbe el yodo del cuerpo. De este modo, se intenta localizar primero y eliminar después cualquier célula tuiroidea que haya quedado remanente tras el tratamiento quirúrgico. . Se administra una cápsula de I-131 con el fin de destruir el tejido tiroideo residual y cualquier resto de tumor que haya podido quedar y para facilitar el seguimiento mediante gammagrafía. No está indicado en todos los casos sólo en aquellos que tras la cirugía tienen los márgenes afectados, hay enfermedad residual, en variedades histológicas agresivas o en casos que tienen algún factor de mal pronóstico. Se realiza de forma complementaria a la cirugía, el mejor momento es a las 3- 4 semanas de la cirugía y la dosis establecida es de 30-10 mCi para eliminar el remanente tiroideo o de 100-200 mCi si hay constancia de enfermedad neoplásica residual. Se tolera bastante bien y tiene pocos efectos secundarios.
3. Tratamiento hormonal para supresión de TSH: el uso de tiroxina después de la cirugía se realiza con dos finalidades: por un lado con fines sustitutivos para preservar la función tiroidea y para disminuir la secreción de TSH (hormona estimulante del tiroides) que puede actuar como factor estimulante de crecimiento y proliferación de las células neoplásicas. Su utilidad está controvertida, aunque en estudios publicados recientemente parece que mantener la supresión durante al menos cinco años puede ser beneficioso.
4. El tratamiento de la enfermedad localizada con radioterapia sólo está indicada en casos seleccionados en los que la extirpación del tumor afecta los márgenes o con factores de mal pronóstico. De manera general, no se considera a los tumores diferenciados o medulares de tiroides como especialmente sensibles al tratamiento radioterápico.
B. Tratamiento de la enfermedad irresecable o enfermedad metastásica.
La recurrencia del tumor en el cuello se puede detectar mediante exploración clínica o elevación de la tiroglobulina en sangre o mediante las pruebas de imagen como la ecografía cervical o el TAC o RM. La mediana de supervivencia en los pacientes con carcinoma diferenciado de tiroides yodorefractario en enfermedad recurrente y/o metastásico es menor de 3 años. Sin embargo, las líneas de investigación actuales han permitido mejorar estos datos gracias a la identificación de mecanismos moleculares implicados en su desarrollo como la angiogénesis o algunas alteraciones moleculares que sirven de “drivers” o conductores del crecimiento celular.
Tratamiento de los tumores diferenciados de tiroides:
La cirugía de las recaídas locales sule ser la principal alternativa terapéutica, junto con la administración del radioyodo (I-131). Entre una una y otra alternativa, la eficacia en el control de la enfermedad se suele localizar en más del 80% de los casos.
Se considera que un paciente es refractario al tratamiento con radioyodo cuando se evidencia crecimiento de las lesiones metastásicas en los 12 meses siguientes a la administración del radioyodo, o bien las lesiones metastásicas no captan radioyodo en la gammagrafía, o bien aparecen nuevas lesiones no captantes, o bien se ha alcanzado una dosis total de radioyodo superior a los 600 mCi.
La quimioterapia no se considera eficaz para el tratamiento de los pacientes con carcinoma diferenciado de tiroides refractarios a radioyodo en el momento actual.
Los inhibidores de tirosina kinasa son fármacos orales que impiden o dificultan la formación de vasos sanguíneos. Principalmente actúan inhibiendo o bloqueando la función del receptor de crecimiento del endotelio vascular y la del receptor de crecimiento derivado de plaquetas, ambos implicados en la formación de los vasos sanguíneos que contribuyen al crecimiento y desarrollo de los tumores tiroideos. Se dispone de tres fármacos de este tipo aprobados para el tratamiento de los carcinomas diferenciados de tiroides refractarios a radioyodo en el momento actual que serían sorafenib, lenvatinib y cabozantinib. Su aprobación por las principales agencias regulatorias se ha basado en el retraso en el crecimiento de las lesiones metastásicas así como la capacidad para inducir la reducción del tamaño de dichas lesiones en un porcentaje significativo de pacientes. Se conoce que un tratamiento secuencial con estos fármacos puede revertir la resistencia al inhibidor de tirosina kinasa que se haya empleado anteriormente, por lo que el empleo de uno u otro estaría condicionado por la estrategia de tratamiento sistémico que se considere más adecuada para cada paciente.
Aunque pertenecen a una misma familia de fármacos tanto la eficacia como el perfil de seguridad de los mismos puede variar entre ellos y se debe adaptar el tratamiento a las características de cada paciente.
El manejo de estos fármacos debe ser llevado a cabo por especialistas con experiencia en el manejo de este tipo de medicamentos.
El mayor conocimiento de la biología molecular de estos tumores ha permitido el desarrollo de terapias dirigidas contra alguna de las principales alteraciones moleculares que se pueden encontrar en estos tumores. Dentro de ellas, destacn 4 alteraciones sobre las cuales se puede actuar desde un punto de vista dirigido:
- Fusiones del gen NTRK: que se pudieran encontrar en aproximadamente en el 12% de los pacientes y que contaría con distintos fármacos como larotrectinib o entrectinib capaces de inducir respuestas significativas en aproximadamente el 70% de los pacientes con metástasis a distancia
- Fusiones del gen RET: que se estima pueden afectar hasta el 20% de los pacientes y que cuenta con fármacos dirigidos como selpercatinib o pralsetinib que inducirían respuestas en torno al 60% de los pacientes
- Mutaciones en el gen BRAF: cuya frecuencia de aparición sería la más elevada, en torno al 45% de los casos, pero con una menor tasa de respuesta al tratamiento dirigido (30% tanto con inhibidores de BRAF como agentes únicos o en combinación con inhibidores de MEK
- Mutaciones que afectan a la vía intracelular de mTOR: que se observarían en el 5% de los casos y que puede condicionar un beneficio clínico a fármacos dirigidos contra esta vía de proliferación y supervivencia celular.
Tratamiento de los tumores medulares de tiroides metastásicos:
La principal alteración molecular que se objetiva en estos tumores es la mutación que afecta al gen RET y que se puede encontrar en prácticamente el 100% de los tumores hereditarios y entre el 50% y el 80% de los esporádicos. El receptor de membrana RET que se localiza en las células tumorales se encontraría implicado en la proliferación, crecimiento y procesos de transición epitelio-mesénquima que originaría las metástais de estos pacientes.
Para el tratamiento sistémico de los pacientes con tumores medulares metastásicos se dispone de dos tipos de tratamientos sistémicos aprobados por las principales agencias reguladoras:
- Inhibidores multikinasas: cuyo mecanismo de acción sería similar al de los aprobados para los tumores diferenciados de tiroides pero que cuentan con actividad también para bloquear el receptor RET:
- Vandetanib: es un potente inhibidor oral de varias dianas. La dosis es de 300 mg al día. Las toxicidades más habituales son diarrea, hipertensión, alteraciones del ECG y astenia (cansancio).
- Cabozantinib: inhibe también varias vías de señalización. Se administra a dosis de 140 mg al día. Los efectos secundarios más frecuentes son diarrea y síndrome palmpoplantar.
- Inhibidores selectivos de RET como selpercatinib y pralsetinib con una mayor capacidad para inducir respuestas radiológicas y un aparecente mejor perfil de seguridad por su mayor selectividad que los tradicionales inhibidores de tirosina kinasa empleados.
Tratamiento de los tumores anaplásicos de tiroides:
Se trata de un tumor de crecimiento muy rápido y agresivo, que amenaza la vida de los pacientes en pocos días. La cirugía y la radioterapia con o sin quimioterapia asociada son las técnicas empleadas en los pocos casos en los que la enfermedad se diagnostica en una etapa localizada. La progresión y la extensión rápida del tumor tanto a nivel local como a distancia es la norma y la quimioterapia basada en antraciclinas y taxanos suelen ser los regímenes más empleados.
Se debe intentar llevar a cabo un estudio molecular de estos pacientes, ya que la expectativa de vida con los tratamientos clásicos apenas excede los 4-6 meses.
Se estima que aproximadamente el 14% de estos pacientes con tumores anaplásicos serían portadores de mutaciones en BRAF que se pudieran beneficiar de inhibidores de BRAF tanto como agentes únicos (dabrafenib o vemurafenib) como en combinación con inhibidores de MEK (trametinib). Estas terapias vendrían ya recogidas en las principales guías internacionales del manejo de estos tumores.
El estudio molecular también nos permitiría identificar a un 5% de pacientes con fusiones en el gen de NTRK o a un 2% de pacientes con fusiones en el gen de RET que pudieran igualmente beneficiarse de un tratamiento selectivo.
En cualquier histología tumoral, se recomienda la participación de los pacientes en los ensayos clínicos disponibles para estos tumores. La Medicina de Precisión es, sin duda, una alternativa de tratamiento para los pacientes con cualquier histología de tumor tiroideo que se debe ofrecer a los pacientes en el día a día.
Revisiones y seguimiento
Una vez tratado con éxito un cáncer de tiroides, hay que realizar revisiones periódicas con el objetivo de detectar las posibles recaídas y controlar los efectos secundarios.
El seguimiento de todo paciente tratado de un cáncer de tiroides siempre debe realizarlo entre otros especialistas un endocrinólogo, ya que la correcta función tiroidea es fundamental para el mantenimiento del resto de las funciones del organismo.
Las pruebas que habitualmente se realizan son las siguientes:
- Anticuerpos anti-tiroglobulina en sangre periférica en aquellos pacientes con tumores diferenciados de tiroides
- Rastreo con I-131.
En las histologías más agresivas o en los tumores medulares, es habitual la realización de TAC Body que incluya cuello, tórax, abdomen y pelvis así como nuevas técnicas de imagen nuclear como el PET marcado con fluoro-deoxi-glucosa (FDG)
En los últimos años estamos asistiendo a un desarrollo de nuevos tratamientos dirigidos frente a dianas moleculares, lo que ha supuesto un aumento en la supervivencia global de los pacientes.




