Cáncer de ovario
Índice de navegación
AUTOR: Dr. Josep Mª. del Campo
Cada mujer tiene dos ovarios que se encuentran a cada lado del útero. El ovario es un órgano, por tanto, intrapelvico (que se encuentra en la pelvis), con forma de almendra y una longitud máxima que oscila entre 2 y 4 centímetros.
Los ovarios desempeñan dos funciones importantes, que son:
- La producción del gameto femenino (ovocito). Cada mes durante la ovulación el ovario libera un ovocito que viaja por la trompa (pequeño conducto que comunica el ovario con el útero) hasta el útero.
- La secreción de hormonas femeninas. El ovario es la fuente principal de estrógeno y progesterona que son las hormonas femeninas implicadas en varios procesos como la regulación del ciclo menstrual, el embarazo, y el crecimiento de las mamas entre otros.
- En la menopausia los ovarios dejan de producir ovocitos y hormonas femeninas.
Datos epidemiológicos
Existen 3 tipos de cáncer de ovario: carcinoma epitelial, tumores de células germinales, tumores del estroma.
- Carcinoma epitelial: representa el 85-90% de los canceres de ovario y será del que hablemos en adelante.
- Tumores de células germinales. Muy infrecuentes
- Tumores del estroma. Aún más infrecuentes.
El cáncer epitelial es la principal causa de mortalidad por cáncer ginecológico.
Esto es debido, como veremos más adelante, a que la mayoría de pacientes (70-80%) se diagnostican en una etapa avanzada de la enfermedad. Globalmente representa el 3% de los tumores en la mujer y es la cuarta causa de muerte por cáncer en mujeres tras el cáncer de pulmón, mama y colon.
La elevada mortalidad del cáncer de ovario se explica por dos razones:
- La ausencia de síntomas específicos al inicio, lo que motiva que la mayoría de pacientes se presenten con enfermedad diseminada al diagnóstico (que es más difícil de curar), y
- La ausencia de métodos de detección precoz (screening) que sean eficaces y estén validadas.
Existen diferencias geográficas en la incidencia de esta enfermedad, siendo más frecuente en países industrializados.
En cuanto a la edad de presentación, el cáncer de ovario es una enfermedad más frecuente en las mujeres postmenopáusicas, con la máxima incidencia entre los 50 y 75 años (la media está alrededor de los 63 años).
Causas y factores de riesgo
La causa del cáncer de ovario continúa sin conocerse. El cáncer de ovario, como otros tumores malignos, se produce como consecuencia de una acumulación de alteraciones genéticas que causa un crecimiento y proliferación incontrolada de las células epiteliales, pero continúan sin conocerse el mecanismo o mecanismos que inducen dichas alteraciones.
Varios estudios epidemiológicos han identificado algunos factores que podrían aumentar el riesgo de la enfermedad:
- Existen algunos estudios que indican que una dieta rica en grasa y la exposición al talco son factores de riesgo, sin embargo no se dispone de estudios concluyentes.
- En cambio si que se conoce la relación del cáncer de ovario con algunos factores hormonales y factores relacionados con la reproducción. Así, las mujeres que no han tenido hijos tienen mayor riesgo de desarrollar la enfermedad. En cambio, el riesgo de padecer cáncer de ovario disminuye en aquellas mujeres que han empleado anticonceptivos orales.
Alrededor del 20% de los cánceres de ovario son hereditarios, asociados en la mayoría de casos a mutaciones de los genes BRCA 1 y BRCA 2.
Estos genes forman parte del grupo de “genes supresores de tumores” y contienen la información para la producción de unas proteínas implicadas en la reparación del ADN y por tanto en el mantenimiento íntegro del genoma.
Parecen existir otros genes implicados, en mayor o menor grado, siendo considerado aun incierto el papel que tienen en el desarrollo del cáncer de ovario.
Es importante destacar que no todas las mujeres con mutaciones de BRCA van a desarrollar cáncer de ovario o mama.
Asimismo, existe la evidencia de que las pacientes portadoras de estas mutaciones tienen una mejor supervivencia. Entre las razones que se citan está el hecho de que son mujeres con controles más exhaustivas y que pueden ser diagnosticadas en una fase más precoz de la enfermedad.
Los criterios para el diagnóstico clínico de un cáncer de mama-ovario hereditarios del Grupo de Trabajo de la Sociedad Española de Oncología Médica son:
- Un caso de cáncer de mama menor o igual a 40 años.
- Diagnóstico de cáncer de mama y ovario en la misma paciente.
- Dos o más casos de cáncer de mama, uno de los cuales es bilateral o en menor de 50 años.
- Un caso de cáncer de mama en mujer de menos de 50 años o bilateral, y un caso de cáncer de ovario en familiares de primer o segundo grado.
- Tres casos de cáncer de mama y ovario (al menos 1 caso de ovario) en familiares de primer o segundo grado.
- Dos casos de cáncer de ovario en familiares de primer o segundo grado.
- Un caso de cáncer de mama en varón y al menos 1 familiar de primer o segundo grado con cáncer de mama u ovario.
Le recomendamos que contacte con su oncólogo o Unidad de Consejo Genético en caso de cumplir con alguno de los criterios anteriores.
Signos y síntomas
Habitualmente las etapas iniciales del cáncer de ovario suelen cursar sin síntomas, o con síntomas muy leves que pasan desapercibidos y se confunden con procesos benignos.
En la cavidad abdominal el tumor puede crecer y diseminarse de manera silente, de manera que cuando causa síntomas ya suele estar diseminado. Incluso los primeros síntomas en las etapas avanzadas son habitualmente bastante vagos en forma de molestias inespecíficas abdominales, por lo que es frecuente que sean ignorados o confundidos con procesos benignos como dispepsia o "gases".
El cáncer de ovario es por tanto difícil de diagnosticar precozmente, y esta es la principal causa de su elevada mortalidad.
A medida que el tumor crece pueden comenzar a aparecer algunos síntomas como pérdida de apetito, sensación de plenitud abdominal tras la comida (aunque esta sea frugal), o pérdida de peso.
En general, se suele acumular líquido en el abdomen causando lo que denominamos ascitis, que puede ser muy importante, y causar distensión de la cavidad abdominal.
También se puede acumular líquido en la pleura en torno a los pulmones y producir dificultad para respirar o sensación de falta de aire.
Por otra parte, el crecimiento de una masa ovárica en la pelvis puede afectar a las estructuras vecinas, principalmente la vejiga y el recto causando síntomas como disuria (dolor o molestia al orinar), diarrea o estreñimiento, y dolor abdominal o pélvico. En la Tabla 1 se enumeran algunos de los síntomas que deben motivar una consulta al médico, especialmente sin son persistentes y/o inusuales:
|
Tabla 1. Síntomas que deben motivar acudir al médico para iniciar estudio |
|
• Distensión abdominal progresiva. |
Diagnóstico
Ante la sospecha de cáncer de ovario, lo primero que se debe realizar a la paciente es una evaluación general consistente en:
- Una historia clínica completa y una exploración física minuciosa con exploración de la pelvis y exploración ginecológica realizada por un ginecólogo.
- Análisis de sangre que incluya marcadores tumorales.
- Exploraciones radiológicas, como TAC, PET-TAC o RMN.
Otras pruebas que se deben realizar son exploraciones radiológicas, es decir pruebas de imagen. Las exploraciones radiológicas que se suelen realizar son:
- Ecografía ginecológica: consiste en la introducción de una sonda de ecografía por vía vaginal. Permite identificar con bastante precisión los ovarios y detectar tumores ováricos así como la presencia de líquido libre en la cavidad pélvica. Esta prueba es necesaria.
- Tomografía Axial Computerizada de abdomen y pelvis: el TAC nos proporciona abundante información sobre el tamaño y localización del tumor en la pelvis, la presencia de afectación de ganglios linfáticos regionales, la existencia de ascitis (líquido libre en la cavidad abdominal) y la presencia de metástasis viscerales en bazo o hígado (que suelen ser poco frecuentes en esta enfermedad).
El TAC también puede detectar implantes peritoneales (implantes tumorales en la cavidad abdominal) que son muy frecuentes en el cáncer de ovario. No obstante, el TAC no suele detectar implantes de menos de 1-2 centímetros, por lo que con frecuencia en los estadios avanzados existe más enfermedad de la que detecta el TAC.
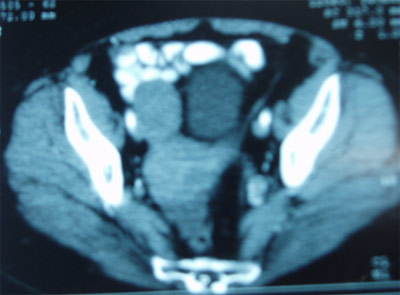
Imagen de TAC de un tumor de ovario derecho
- Resonancia Nuclear Magnética (RNM): en general no es una prueba que se haga de rutina. Puede ser más útil que el TAC para detectar la infiltración de órganos pélvicos (como vejiga o recto) por el tumor. Rara vez es necesario realizar una RNM.
- PET-TAC: el PET-TAC se está imponiendo como exploración para determinar la extensión de la enfermedad, una vez llegados al diagnóstico de cáncer de ovario. Puede dar en ocasiones una información más exhaustiva antes de la decisión del tratamiento.
- Ocasionalmente se realiza una cistoscopia para conocer si está infiltrada la vejiga o una rectoscopia para conocer si está infiltrado el recto, antes de programar la cirugía.
- También se debe realizar la cuantificación del marcador tumoral CA 125. Esta prueba consiste en un análisis de sangre por el que se mide dicha proteína en el suero de la paciente, ya que en general está aumentada en las pacientes que padecen un cáncer de ovario.
- Sin embargo, hay pacientes que no presentan elevación del marcador CA 125, y además, puede estar aumentado también en enfermedades benignas que cursan con ascitis (líquido en la cavidad abdominal) o inflamación de la cavidad peritoneal.
- La utilidad principal de esta prueba radica en el seguimiento de la enfermedad, puesto que suele existir una correlación entre el nivel de CA 125 y la actividad de la enfermedad.
- En toda paciente con el diagnóstico clínico de tumor de ovario se debe realizar una laparotomía para la toma de biopsia, pues es la prueba que nos servirá para realizar a la vez el diagnóstico definitivo y la estadificación de la enfermedad. La laparotomía puede ir precedida de una laparoscopia exploradora para definir mejor las opciones de una cirugía óptima.
Anatomía patológica
El diagnóstico definitivo de cáncer de ovario lo establece el médico especialista en anatomía patológica tras analizar por el microscopio el tumor del ovario o un implante que le ha remitido el cirujano.
Más del 90% de los cánceres de ovario son de origen epitelial, y sobre ellos desarrollaremos más adelante el tratamiento. Existen varios subtipos de cáncer epitelial de ovario que se denominan:
- Seroso
- Endometriode
- Células claras
- Mucinoso
- Indiferenciado
A su vez según el grado de diferenciación se clasifican en:
- Bien diferenciados o grado 1
- Moderadamente diferenciados o grado 2
- Pobremente diferenciados o grado 3
El grado de diferenciación se determina por la apariencia de las células, aquellas con apariencia más madura con formación de estructuras glandulares son las bien diferenciados, mientras que las células de aspecto más agresivo y menos diferenciadas son las de alto grado o grado 3.

Imagen de carcinoma seroso papilar de ovario. Cortesía del Servicio de Anatomía Patológica del Hospital Ramón y Cajal
Aunque esta clasificación es la que viene siendo utilizada habitualmente, hoy en día sabemos que cada uno de los subgrupos viene tambien definido por distintos patrones de expresión génica.
Los tumores serosos son los más frecuentes (70%) y entre ellos los de alto grado (tambien clasificados como Tipo 1) tienen características moleculares distintas a los de bajo grado (Tipo 2), con implicaciones terapéuticas.
Asimismo, hoy en día sabemos que en el tipo histológico seroso-papilar de alto grado encontramos diferentes subtipos: mesenquimal, diferenciado, inmunoreactivo y proliferativo, atendiendo a su distinta expresión génica.
Palmirotta R, et al. Crit Rev Oncol Hematol. 2017;117: 12-29.
Estadificación
Primera Cirugía Del Cáncer De Ovario: Laparotomía Diagnóstica y de Estadificación
Ante la sospecha clínica de cáncer de ovario, la primera maniobra diagnóstica y terapéutica debe consistir en una laparotomía (apertura quirúrgica de la cavidad abdominal) con fines diagnósticos, de estadificación y terapéuticos. Sin embargo, en ocasiones puede ser recomendable una laparoscopia previa para determinar si la cirugía recomendada es posible, además de permitir una biopsia apropiada.
El diagnóstico definitivo de un cáncer de ovario requiere el análisis histopatológico (por el Servicio de Anatomía Patológica) del tumor ovárico. Además, a diferencia de otros tumores, la estadificación (determinación de la extensión de la enfermedad) del cáncer de ovario es quirúrgica, pues es precisa la visualización directa de toda la cavidad abdominal.
Dicha exploración debe ser realizada por un cirujano-ginecólogo con experiencia en el tratamiento de cáncer de ovario. La intervención de laparotomía de estadificación es una intervención compleja en la que se debe realizar una exploración minuciosa de la cavidad abdominal y pélvica, así como de los ganglios linfáticos con el fin de determinar con exactitud la extensión de la enfermedad.
Tras esta primera aproximación, lo habitual es que el cirujano-ginecólogo extirpe el ovario tumoral o una muestra de tejido, con el fin de que el patólogo (médico especialista en Anatomía Patológica) realice un primer diagnostico durante la intervención (diagnóstico intraoperatorio).
En caso de que el patólogo confirme que se trata de un cáncer de ovario, el cirujano-ginecólogo proseguirá con la cirugía puesto que el tratamiento inicial del cáncer de ovario es quirúrgico.
Estadios
Como en otros tumores, el cáncer de ovario se clasifica en varios estadios según la extensión de la enfermedad (Tabla 2 ).
El estadio de la enfermedad (su grado de extensión) es el factor pronóstico más importante. Así, las pacientes con tumores en estadios iniciales (estadios I y II) tienen una mayor supervivencia que las pacientes con tumores avanzados (estadios III y IV), y menor probabilidad de recurrencia tras el tratamiento (Tabla 3).
|
Tabla 2: Estadificación quirúrgica del cáncer de ovario (Estadios de la FIGO) |
|
|
I |
Tumor limitado a los ovarios |
|
IA |
Tumor limitado a un ovario o trompa de Falopio, sin ascitis, sin implantes en la superficie del ovario y con la cápsula del ovario intacta. |
|
IB |
Tumor limitado a ambos ovarios o trompas, sin ascitis, sin implantes en la superficie del ovario y con la cápsula del ovario intacta. |
|
IC |
Tumor limitado a uno o ambos ovarios o trompas, con alguno de los siguientes: IC1: Diseminación quirúrgica. |
|
II |
El tumor afecta a uno o ambos ovarios con extensión a óganos o estructuras de la pelviso cáncer primario peritoneal |
|
IIA |
Extensión al útero o a las trompas de Falopio. |
|
IIB |
Extensión a otros tejidos pélvicos. |
|
III |
Tumor en uno o ambos ovarios o trompas, con implantes fuera de la pelvis y/o en los ganglios linfáticos retroperitoneales pélvicos o para-aórticos |
|
IIIA1
IIIA2 |
Tumor con afectación solo de ganglios retroperitoneales (confirmados histológicamente). Tumor con implantes microscópicos fuera de la pelvis (en la cavidad abdominal), con o sin afectación ganglionar retroperitoneal. |
|
IIIB |
Tumor macroscópico con implantes de 2cm o menos fuera de la pelvis (en la cavidad abdominal), con o sin ganglios retroperitoneales afectados. |
|
IIIC |
Tumor macroscópico con implantes de 2cm o más, fuera de la pelvis (en la cavidad abdominal), con o sin ganglios retrperitoneales afectados. Incluye extensión a la cápsula hepática o bazo. |
|
IV |
Presencia de metástasis a distancia. Incluye derrame pleural, parenquima hepático o de bazo, ganglios inguinales o extraabdominales, invasión transmural de intestino. |
Pronóstico
Los dos factores pronóstico más importantes son el estadio y el tumor residual tras la cirugía.
Otros factores a considerar como favorables son: edad más joven, buen estado funcional, tipo celular serosopapilar, tumor bien diferenciado, ausencia de líquido abdominal, presencia de mutación de BRCA.
La supervivencia global del cáncer de ovario se aproxima al 50%, sin embargo, varía en función de los distintos factores pronóstico mencionados anteriormente, siendo el principal la extensión de la enfermedad al diagnóstico. En la Tabla 3 se recoge la supervivencia estimada a 5 años del cáncer epitelial de ovario en función del estadio. (Las estadísticas en cáncer deben ser valoradas con cautela.
Las cifras que se expresan se basan en el análisis de miles de casos, pero la supervivencia específica de una paciente individual puede ser diferente por diversos motivos, por ejemplo: el resultado de la cirugía.
|
Tabla 3. Supervivencia estimada a 5 años según el estadio FIGO |
|
|
Estadio I. Tumor limitado al ovario |
90% |
|
Estadio II. Tumor extendido a órganos vecinos |
65-70% |
|
Estadio III y IV. Tumor extendido a distancia |
20-30% |
Tratamiento
El tratamiento del cáncer de ovario consiste en la combinación de cirugía con la extirpación quirúrgica de todo el tumor existente visible, seguido de quimioterapia.
Conceptos generales
En el tratamiento del cáncer de ovario participa un equipo de especialistas formado principalmente por ginecólogos-cirujanos y oncólogos médicos. El tratamiento de una paciente determinada depende de varios factores de los cuales los más importantes son el grado de extensión de la enfermedad y la situación clínica de la paciente.
El tratamiento del cáncer de ovario consiste en la extirpación quirúrgica de todo el tumor existente, visible. Lo que se conoce como Cirugía óptima. Seguido en la mayoría de las ocasiones por un tratamiento de quimioterapia. A continuación se expone con más detalle el tratamiento, desde el punto de vista teórico, dependiendo de si se trata de estadios iniciales o avanzados. Para un caso concreto se recomienda que hable con su doctor para que le explique las opciones de su caso.
TRATAMIENTO DE LOS ESTADIOS INICIALES
Cuando al intervenir una paciente con la sospecha de cáncer de ovario, el cirujano-ginecólogo se encuentra una masa en el ovario sin evidencia de que exista enfermedad diseminada por el abdomen o la pelvis, lo primero que realiza es la extirpación de dicho ovario y lo remite al patólogo.
Una vez confirmado que se trata de un cáncer de ovario, el cirujano continúa la intervención con el fin de completar la estadificación de la enfermedad para conocer con detalle si la enfermedad ha podido extenderse fuera del ovario. Dicho proceso de estadificación se realiza mediante un protocolo quirúrgico que incluye lo siguiente:
- La extirpación del otro ovario y del útero.
- Extirpación de parte de la grasa que se encuentra por delante del intestino (omento).
- Toma de muestras (biopsias) en varias localizaciones de la cavidad abdominal y en cualquier zona sospechosa.
- Toma de biopsias de los ganglios linfáticos.
El análisis patológico de todas estas muestras determinará la estadificación definitiva de la enfermedad (ver tabla 2).
En la mayoría de pacientes con estadio I (tumor limitado a los ovarios), la cirugía consigue la curación de la enfermedad. Sin embargo, existe un 20-30% de pacientes que presentaran recaída de la enfermedad y que teóricamente se pueden beneficiar de un tratamiento médico complementario a la cirugía.
Los factores que se han asociado a un mayor riesgo de recaída son:
- El grado histológico: Las pacientes con tumores grado 3 tienen una supervivencia menor que las pacientes con grado 1.
- El estadio: la supervivencia a 5 años tras la cirugía sin tratamiento complementario es superior al 90% en estadios IA-IB y se sitúa en torno al 70-80% en estadios IC.
- La ruptura de la cápsula ovárica, bien durante la cirugía o antes de la misma.
Sobre la base de estos factores pronósticos se han dividido a las pacientes en dos grandes grupos (tabla 4): 1) pacientes de bajo riesgo, que presentan una supervivencia a 5 años superior al 90 % y no requieren tratamiento complementario tras la cirugía, y 2) pacientes de alto riesgo, que son aquellas que presentan mayor probabilidad de recaída a 5 años (riesgo de recaída 20-40%) y se podrían beneficiar de un tratamiento complementario.
|
Tabla 4. Grupos de riesgo en cáncer de ovario inicial |
|
|
BAJO RIESGO |
ALTO RIESGO |
|
IA-IB grado 1 |
Grado 2-3 |
|
NO indicación de quimioterapia complementaria |
SI indicación de quimioterapia complementaria |
Existen datos de ensayos clínicos que demuestran que administrar un tratamiento de quimioterapia basado en cisplatino o carboplatino aumenta la supervivencia de mujeres operadas de cáncer de ovario en estadio precoz que presentan algún factor de mal pronóstico.
No está definido el mejor esquema de quimioterapia en esta situación ni el número de ciclos óptimo. Se debe emplear un esquema que contenga carboplatino o cisplatino y administrar al menos 3-4 ciclos. El tratamiento más empleado es paclitaxel y carboplatino.
En conclusión, con el fin de evitar la recurrencia y aumentar la supervivencia, la mayoría de las pacientes suelen recibir un tratamiento complementario con quimioterapia basada en paclitaxel y carboplatino. Tan sólo en las pacientes con tumores muy precoces en estadios IA-IB de bajo grado (grado 1) se recomienda exclusivamente hacer seguimiento, pues la cirugía sola es prácticamente curativa.
TRATAMIENTO DE LOS ESTADIOS AVANZADOS
Cirugía como tratamiento inicial en los estadios avanzados
Lo que suele encontrar el cirujano-ginecólogo al abrir la cavidad peritoneal en las pacientes con estadios avanzados, es que el tumor se ha extendido fuera de los ovarios y presenta múltiples implantes de diferentes tamaños en la cavidad abdominal y pélvico.
En estas pacientes, además del procedimiento quirúrgico que se realiza en los estadios iniciales (extirpación del útero y los ovarios) debe intentarse extirpar, todo el tumor visible existente en la cavidad abdominal incluyendo, si es necesario, segmento intestinal, áreas hepáticas o de bazo...
El objetivo es intentar quitar todo el tumor visible, puesto que se sabe que en aquellas pacientes en las que no se deja tumor macroscópicamente visible presentan mayor supervivencia que aquellas en las que se deja tumor residual.
Esta cirugía (citorreductora) no siempre es posible, considerándose óptima sólo cuando no queda enfermedad residual. En estos casos, se consigue un aumento de la supervivencia.
Tratamiento de quimioterapia como tratamiento inicial en estadios avanzados (neoadyuvante)
Los esquemas de tratamiento y los fármacos que se administran son los mismos que en caso de la quimioterapia adyuvante, que se comenta a continuación. Habitualmente se administran 3 o 4 tratamientos.
Con la quimioterapia neoadyuvante se pretende obtener una reduccion del tumor, suficiente para que seguidamente se practique la cirugía, con más opciones de conseguir una citorreducción óptima.
La cirugía efectuada tras quimioterapia neoadyuvante se denomina Cirugía de Intervalo.
Tratamiento de quimioterapia tras la cirugía (adyuvante)
Los efectos secundarios más frecuentes de la combinación de paclitaxel y carboplatino son:
Esta última se fundamenta en varios principios:
- El cáncer de ovario es una enfermedad limitada a la cavidad peritoneal durante casi toda su evolución.
- Los fármacos administrados directamente en la cavidad peritoneal alcanzan un concentración dentro la cavidad mucho mayor que cuando se administran por vía intravenosa.
- Existe una relación entre dosis de quimioterapia y respuesta en cáncer de ovario.
- La quimioterapia intraperitoneal atraviesa escasos milímetros dentro del tumor por lo que este procedimiento sólo se puede usar en pacientes con cáncer de ovario avanzado en los que se consigue una citorreducción completa (no dejar ningún residuo de tumor) o implantes residuales de menos de 10 mm.
Las limitaciones de la quimioterapia intraperitoneal residen en gran parte en complicaciones relacionadas con el catéter y el procedimiento:
- Obstrucción al flujo o mala distribución del tratamiento.
- Infección: peritonitis, pared abdominal o catéter.
- Perforación intestinal.
Existen datos procedentes de ensayos clínicos comparativos que demuestran un aumento de supervivencia con la administración de quimioterapia intraperitoneal frente a la administración intravenosa en pacientes con cáncer de ovario avanzado tras una citorreducción completa (no dejar ningún residuo de tumor) o con implantes residuales de menos de 10 mm).
El esquema que ha demostrado un beneficio más claro consiste en paclitaxel administrado el día 1º por vía intravenosa, cisplatino administrado por vía intraperitoneal el día 2º y paclitaxel administrado por vía intraperitoneal el día 8º, repitiendo los ciclos cada 21 días.
También estos estudios han demostrado que los esquemas de quimioterapia intraperitoneal disponibles actualmente son significativamente más tóxicos que los esquemas intravenosos.
Esto hace que sólo sean candidatas a este sistema de tratamiento aquellas pacientes que tengan una buena situación clínica general que les permita tolerar el tratamiento.
De hecho con el esquema anteriormente citado, sólo el 40% de pacientes son capaces de completar 6 tratamientos. El resto ha de abandonar precozmente debido a los efectos secundarios.
Los efectos secundarios que son más frecuentes con la quimioterapia intraperitoneal incluyen: leucopenia, nauseas y vómitos, dolor abdominal, infecciones, cansancio, neuropatía periférica, trastornos renales y metabólicos.
Actualmente, la quimioterapia intraperitoneal se considera una opción estándar en pacientes con citorreducción óptima debido al aumento de supervivencia demostrado. Es una alternativa que debe considerarse en centros especializados para pacientes con buen estado general y una adecuada cirugía.
Tratamientos complementarios asociados a la quimioterapia estándar
El único fármaco antiangiogénico aprobado en cáncer de ovario, hace más de 15 años, es el bevacizumab para su empleo en asociación a quimioterapia en pacientes con cáncer de ovario epitelial avanzado. Su aprobación como parte del tratamiento inicial está recomendada para aquellas pacientes que presentan un peor pronóstico (Estadios III-IV, y/o en aquellos casos que presentan enfermedad residual tras la cirugía. Su aprobación se extiende tambien a los casos en que la enfermedad ha recidivado.
Bevacizumab es un anticuerpo monoclonal que bloquea el factor de crecimiento del endotelio vascular (VEGF) y que se administra por vía intravenosa cada 21 días. Su combinación con quimioterapia (paclitaxel y carboplatino) seguido de un periodo de tratamiento con el propio bevacizumab durante unos meses (aproximadamente un año) en pacientes con cáncer de ovario avanzado ha mostrado un incremento moderado del periodo de tiempo con enfermedad controlada.
Los principales efectos secundarios asociados a bevacizumab son la hipertensión y la proteinuria (perdida de proteínas por la orina). Otros efectos graves pero afortunadamente poco frecuentes son las trombosis, sangrados, perforaciones intestinales o fístulas.
Aproximadamente un 30% de las pacientes con cáncer de ovario presentan estas mutaciones, pero además un 20-30% adicional tienen alguna alteración en las vías de reparación del DNA. Los inhibidores PARP son especialmente activos tanto en las primeras como en las segundas.
En la actualidad hay dos fármacos aprobados para su uso en la enfermedad inicial: Olaparib y Niraparib, dada su eficacia demostrada reduciendo el riesgo de recidiva y aumentando notablemente el tiempo en que la paciente está libre de enfermedad. Asimismo, los anteriores junto con Rucaparib tambien están aprobados en las recaidas de la enfermedad. La posibilidad de asociar inhibidores de PARP con Bevacizumab aparece recientemente como una nueva opción de tratamiento en la enfermedad inicial.
Inmunoterapia
También en cáncer de ovario la inmunoterapia ha irrumpido recientemente como una nueva opción de tratamiento. Hoy en día aun se están desarrollando los ensayos clínicos destinados a demostrar su posible eficacia.
TRATAMIENTO DE LAS RECAÍDAS
El 70% de las pacientes con cáncer de ovario se diagnostican en fase avanzada (Estadíos III y IV). A pesar de un adecuado tratamiento inicial y de la eficacia de los fármacos, un gran número de pacientes, presentan recaídas.
Es frecuente que las pacientes presenten múltiples recaidas y que por tanto precisen distintos tratamientos para cada una de ellas.
En la mayoría de pacientes el tratamiento de la recaída se basa nuevamente en quimioterapia asociada, si es posible, a bevacizumab o a inhibidores de PARP. El objetivo del tratamiento es prolongar la supervivencia de las pacientes, mejorar los síntomas que puedan presentar y mantener la calidad de vida.
En algunas pacientes seleccionadas (aquellas con recaída en escasas localizaciones y/o tardía, y con buena situación clínica general) se puede plantear además una cirugía de rescate (con los mismos objetivos que en la cirugía primaria, es decir obtener una resección completa del tumor) seguida de tratamiento al igual que en la primera línea. En estos casos, los resultados son mejores que utilizar solo quimioterapia.
En las recaidas, existen varios fármacos y combinaciones de fármacos que han demostrado ser útiles. La selección de uno u otro tratamiento se basa en diferentes criterios clínicos entre los que cabe destacar:
- La presencia o no de mutaciones de BRCA.
- La respuesta al tratamiento previo de quimioterapia.
- El intervalo de tiempo transcurrido desde que finalizó dicho tratamiento, considerando cuantos y tipo de tratamientos recibidos (platino, no platino, biológico y tipo).
- La toxicidad residual del tratamiento previo.
- La situación de la paciente.
- El estado físico de la paciente.
La probabilidad de respuesta a una segunda o posteriores líneas de tratamiento en las recaídas depende de los factores antes mencionados. Aquellas pacientes que inicialmente respondieron a platino y gozan de intervalos libres de tratamiento superiores a 6-12 meses, presentan mayor probabilidad de responder a la reintroducción de una combinación con platino, en ausencia de toxicidad o intolerancia. Como alternativa, existen opciones sin platino.
Los esquemas que actualmente tienen mayor aval científico (derivado de estudios clínicos comparativos) son: paclitaxel-carboplatino, carboplatino-gemcitabina y carboplatino-doxorubicina liposomal pegilada.
En cambio, la reintroducción de platino en pacientes con recaídas tempranas produce escasas respuestas al mismo, siendo entonces necesario optar por otros fármacos o recomendar la participación en algún ensayo clínico.
Lógicamente en este grupo de pacientes el objetivo fundamental del tratamiento es el control de los síntomas relacionados con la enfermedad, procurando no empeorar su calidad por los efectos secundarios del tratamiento.
Tratamiento con Bevacizumab en la recidiva
Bevacizumab combinado con quimioterapia obtiene una mayor y más duradera respuesta, comparado con la quimioterapia sola. Su recomendación puede excluir a algunas pacientes que no cumplan los requisitos para su uso, según los criterios seguidos para su aprobación.
Tratamiento con inhibidores de la enzima PARP en la recidiva
En pacientes con recidiva de la enfermedad y que vuelven a responder al tratamiento con platino y que son portadoras de mutaciones en los genes BRCA1 y BRCA2 (20%) o presentan alguna mutación en esta vía, se ha observado un gran beneficio cuando son tratadas con inhibidores de PARP.
En este momento, para pacientes en recidiva que mantienen la sensibilidad a platino hay tres fármacos aprobados en nuestro pais: Olaparib, Niraparib y Rucaparib. Todos ellos se administran como tratamiento de mantenimiento tras responder a una quimioterapia basada en platinos.
Su nivel de eficacia es muy similar y difieren en algunos efectos secundarios. Asimismo, pueden haber pequeñas diferencias entre ellos, según las características mutacionales de las pacientes.
Ensayos clínicos en cáncer de ovario
Los resultados globales del tratamiento actual del cáncer de ovario avanzado no son plenamente satisfactorios, ya sea porque se diagnostica en una fase avanzada o porque el tratamiento tiene una eficacia, en ocasiones limitada.
Los ensayos clínicos, con nuevos fármacos exploran nuevos tratamientos o estrategias terapéuticas dirigidos a aumentar las tasas de curación o prolongar la superviviencia.
Los ensayos clínicos están diseñados por personas expertas en el tratamiento de cáncer de ovario, se realizan mediante el cumplimiento de un protocolo estricto bajo la supervisión de un equipo cualificado y requieren la autorización de las Autoridades Sanitarias y Comités de Ética.
La inmunoterapia se está incorporando a todos los estudios, en combinación con los tratamentos ya existentes. Es probable que en los próximos años se tengan los resultados que demuestren su eficacia.
Además de todo lo anterior, son numerosos los nuevos fármacos que se están estudiando en cáncer de ovario. Fármacos que actúan en forma distinta a los que ya conocemos y que pueden aportar beneficios adicionales.
Gracias a los ensayos clínicos conocemos cuales de los nuevos fármacos que aparecen sirven realmente para aumentar la supervivencia de las pacientes con cáncer de ovario.




