AUTORAS: Dra. Ana Blasco
Dra. Cristina Caballero
Introducción
Hoy en día disponemos de un amplio arsenal de fármacos con actividad antineoplásica. En las páginas siguientes se exponen los efectos secundarios principales de los quimioterápicos clásicos así como de los nuevos fármacos, dirigidos contra las dianas moleculares.
Los quimioterápicos ejercen su acción actuando sobre las células cancerígenas, derivadas de células sanas y que comparten con éstas procesos metabólicos y funcionales, por lo que cualquier fármaco que actué sobre ellas también lo hará en mayor o menor grado sobre todas las demás células del organismo. De ahí que los tratamientos quimioterápicos asocian una serie de efectos más o menos graves, sobre el resto del organismo denominándose efectos tóxicos o secundarios. Las células más afectadas por el efecto citotóxico de la quimioterapia son aquellas que comparten características con las células tumorales, especialmente la multiplicación celular a gran velocidad, como son las de los folículos pilosos, de la médula ósea, el tubo digestivo y el sistema reproductor.
En los últimos años se han incorporado a los tratamientos disponibles nuevos fármacos denominados de forma general agentes biológicos diana-específicos, fármacos antidiana o terapias dirigidas. Se trata de fármacos que reconocen las características específicas de las células tumorales, actuando directamente sobre proteínas o mecanismos implicados en la proliferación y crecimiento de las células tumorales y que constituyen parte fundamental para el desarrollo de la célula tumoral. Entre estos se incluyen: imatinib (Gleevec), trastuzumab (Herceptin), rituximab (Rituxan), erlotinib (Tarceva), bevacizumab (Avastin), cetuximab (Erbitux) y sorafenib (Nexavar).
El objetivo de estos nuevos fármacos es bloquear moléculas específicas de las células cancerosas para retardar o detener el crecimiento del cáncer. En comparación con la quimioterapia convencional, estos fármacos son más específicos y generan menos efectos secundarios asociados con la quimioterapia. Aún así, su espectro de toxicidad, el rango de gravedad de ésta y los posibles efectos adversos derivados de un uso prolongado de los mismos aún permanece en estudio, presentado la mayoría de los pacientes problemas en la piel, el cabello, las uñas o los ojos.
La toxicidad asociada al tratamiento quimioterápico es un aspecto muy importante, principalmente por la influencia negativa que ejerce sobre la calidad de vida de los pacientes, así como el riesgo vital que puede suponer en algunas circunstancias.
Los efectos secundarios producen gran temor en los pacientes, aunque en la mayoría de los casos son más soportables de lo esperado.
¿CÓMO SE EVALUA LA TOXICIDAD?
Muchos de los efectos tóxicos podrían ser evitados o minimizados mediante una exhaustiva evaluación tras cada ciclo de quimioterapia.
La toxicidad debe ser evaluada en cuanto a severidad, frecuencia y duración, teniendo en cuenta que tiene dos dimensiones una subjetiva y otra objetiva. Es preciso informar a su doctor de la severidad y de la duración de la toxicidad. Las toxicidades objetivas se evalúan mediante el examen físico o los análisis de laboratorio.
La toxicidad debe evaluarse a corto y a largo plazo, siendo está muy importante en aquellas situaciones en que existe una elevada probabilidad de curación (aparición de segundas neoplasias o leucemias en pacientes jóvenes tratados de cáncer de testículo o linfomas).
Los criterios comunes de toxicidad (CTC) son un sistema ordenado según la severidad y la afectación de los diferentes órganos o sistemas. Cada centro puede emplear un sistema de gradación de la toxicidad, siendo los más empleados: los del NCI, ECOG u OMS. En los informes médicos puede ver reflejado un número del 0-4 asociado a un efectos indeseable (ej Nauseas G2).
Es importante conocer los efectos secundarios asociados a cada tipo de fármaco quimioterápico, para de esta manera prevenir la aparición de toxicidad lo que permita tener un buen control sintomático y una mayor calidad de vida.
Tabla 1.- Clasificación de la toxicidad en función del momento de aparición.
|
TOXICIDAD INMEDIATA
(Horas-días tras QT)
|
TOXICIDAD PRECOZ
Días-semanas tras QT
|
TOXICIDAD RETARDADA
Semanas-meses tras QT
|
TOXICIDAD TARDIA
Meses-años tras QT
|
|
Vómitos
Fiebre
Hiper/Hipotensión
Flebitis
Insuficiencia renal aguda
Reacciones alérgicas
Rash cutáneo
Cistitis hemorrágica
Necrosis tisular local
|
Alopecia
Aplasia medular: leucopenia, anemia, trombopenia
Mucositis
Diarrea
Íleo paralítico
Hiperglucemia
Psicosis
Retención hídrica
Síndrome pseudogripal
|
Ototoxicidad
Anemia
Aspermia
Pigmentación cutánea
Fibrosis pulmonar
Neuropatía periférica
Cardiotoxicidad
Fibrosis del conducto lagrimal
Ataxia cerebelosa
Daño hepatocelular
Fenómeno de Raynaud
Síndrome hemolítico-urémico
Hiperpigmentación cutánea
|
Hipogonadismo/esterilidad
Leucemias agudas
Linfomas
Encefalopatía
Cataratas
Carcinogénesis
Menopausia precoz
Fibrosis hepática/cirrosis
Osteoporosis
|
TOXICIDADES MÁS COMUNES
Es importante señalas que no todas las personas experimentan todos los efectos secundarios, ni en el mismo grado, incluso en un porcentaje importante de pacientes éstos son leves o incluso inexistentes.
La prevención de los efectos secundarios, por medio de la información y de los tratamientos de soporte logra minimizar su gravedad.
La mayoría de los efectos secundarios desaparecen gradualmente después de que termina el tratamiento, aunque en ocasiones pueden producir daños permanentes.
Los efectos secundarios más comunes son los que aparecen de manera inmediata o precoz:
- Caída del cabello (Alopecia)
- Náuseas y vómitos.
- Cansancio.
- Anemia.
- Infección.
- Dermatitis, Acné
- Aparición de moraduras
- Disminución del apetito y pérdida de peso
- Llagas en la boca (Mucositis)
- Sequedad de piel
- Cansancio (Astenia)
TOXIDAD DE LOS NUEVOS FARMACOS ANTIDIANA
A pesar de la gran selectividad de estas terapias dirigidas emergen una serie de efectos colaterales, a veces impredecibles.
Las toxicidades más comunes son:
- Cutánea
- Cardiovascular:
o Hipertensión arterial
o Insuficiencia Cardiaca
o Cambios en el electrocardiograma
- Gastrointestinal: Diarrea
- Pulmonar: Enfermedad pulmonar intersticial
- Hepática
- Alteraciones hidroelectrolítica
A continuación se enumeran los principales fármacos antidiana, con sus toxicidades más frecuentes, que se explican en las páginas siguientes:
|
Trastuzumab
|
Cardiotoxicidad.
Reacciones en sitio de infusión.
Neutropenia.
|
|
Imatinib
|
Cardiotoxicidad.
Edemas.
Nauseas.
Mielosupresión.
|
|
Desatinib
|
Cardiotoxicidad.
Mielosupresión.
Edemas.
Derrame pleural/pericárdico.
Prolongación QT.
Sangrado.
|
|
Nilotinib
|
Cardiotoxicidad.
Hiperbilirrubinemia.
Rash.
Prolongsción QT.
|
|
Sunitinib
|
Cardiotoxicidad.
Hemorragias.
Hipertensión arterial.
Disfunción adrenal.
Alteraciones del color de piel y cabello.
Hipotiroidismo.
|
|
Sorafenib
|
Cardiotoxicidad.
Diarrea.
Nauseas y vómitos.
Dispepsia.
Hipertensión arterial.
Rash.
Mucositis y estomatitis.
Hemorragia.
Síndromes coronarios.
|
|
Bevacizumab
|
Cardiotoxicidad.
Hemorragia.
Perforación intestinal.
Hipertensión Arterial.
Neutropenia.
Complicaciones de cicatrización.
Tromboembolismo arterial.
|
|
Lapatinib
|
Rash.
Diarrea.
|
|
Gefitinib
|
Rash.
Diarrea.
Nauseas.
Patología pulmonar intersticial.
|
|
Erlotinib
|
Rash.
Patología pulmonar intersticial.
Diarrea.
|
|
Cetuximab
|
Rash.
Reacción en punto de infusión
Patología pulmonar intersticial.
Hipomagnesemia.
|
|
Panitumumab
|
Rash.
|
|
Temsirolimus
|
Astenia
Estomatitis
Neumonitis
Infecciones
Toxicidad cutánea
|
|
Pazopanib
|
Toxicidad hepática
Hipertensión Arterial
Toxicidadcardiaca
Diarrea
Nauseas-Vómitos
Astenia y Anorexia
Cambios en la coloración del cabello
|
|
Everolimus
|
Neumonitis intersiticial
Estomatitis
Astenia
Infecciones
|
Cansancio (Astenia)
El cansancio asociado al cáncer o astenia se define como la sensación de agotamiento físico, emocional y mental persistente, pudiendo estar producido por la propia enfermedad o por sus tratamientos. Se describe como una falta de energía que impide realizar incluso pequeños esfuerzos cotidianos o una falta de fuerzas generalizada que no encuentra alivio con el descanso. Puede afectar seriamente las actividades cotidianas de una persona, incluida su capacidad para trabajar, compartir actividades con su familia o socializar.
Es común que la fatiga aparezca después del tratamiento, en los momentos siguientes:
- Unos pocos días después de la quimioterapia
- Unas pocas semanas después de comenzar la radioterapia
- Después de la inmunoterapia por ejemplo con interferón alfa (Roferon-A, Intron A) o las interleuquinas (Proleukin)
Es una de las complicaciones más frecuentes, apareciendo hasta en el 90% de los pacientes con cáncer que reciben tratamiento. Puede persistir durante meses o años tras finalizar el tratamiento en más del 50% de los pacientes.
El cansancio también aparece en los nuevos tratamientos con agentes antidiana. En ocasiones la astenia está relacionada con la aparición de un hipotiroidismo, siendo una causa tratable de astenia (ocurre en más del 50 % de pacientes tratados con Sunitinib). Por ello, en pacientes que presenten astenia y que además asocien cambios en la piel, cambios en la voz o estreñimiento es obligatorio realizar un adecuado estudio tiroideo.
¿Cómo evaluar el cansancio?
Pese a la alta frecuencia de cansancio en los pacientes, se trata de un síntoma al que en ocasiones no se da demasiada importancia, de ahí la necesidad de informa a su oncólogo de su presencia.
Para evaluar el cansancio la mejor manera es describir el grado de cansancio, para ello se puede utilizar una escala de 0 a 10, de manera, que cero sería ausencia de cansancio y 10 el peor cansancio imaginable (4-6 cansancio moderado, 7-10 cansancio intenso).
Los principales signos del cansancio asociado al cáncer son:
- Cansancio que no disminuye pese a descanso.
- Presenta cansancio muy intenso tras la actividad física cotidiana
- Presenta cansancio sin realizar actividades físicas
- El descaso no lo alivia
- Presenta dificultad para concentrarse
- El cansancio interfiere la vida cotidiana, dificultando las relaciones sociales, el trabajo…
- Necesita permanecer en la cama durante más tiempo del necesario.
Es importante recoger el máximo de datos sobre el cansancio, para ello puede ser de ayuda contestar estas preguntas:
- ¿Desde cuando presenta cansancio?
- ¿Ha aumentado desde el diagnóstico o con los tratamientos?
- ¿Mejora o empeora con el descanso? ¿Qué es lo que le alivia?
- ¿Cómo afecta a su vida cotidiana?
En ocasiones su doctor le solicitará una analítica para descartar que la fatiga esté causada por una anemia (baja cantidad de glóbulos rojos) o por algún otro problema.
Tratamiento
Si conocemos la causa del cansancio el tratamiento debe ir enfocado a corregirla. Se recomienda la corrección de los desequilibrios de líquidos y minerales, así como la realización regular de ejerció físico adecuado a la situación de cada paciente. Su médico decidirá si precisa algún tratamiento farmacológico que mejore el síntoma. Otras medidas que pueden ayudarle:
1) Ejercicio: Aunque la realización de un esfuerzo físico puede suponer un esfuerzo considerable, el aumento de la actividad física puede reducir realmente el cansancio. Los estudios realizados demuestran que los pacientes con cáncer que realizan ejercicio constante (30 minutos diarios o 3-4 horas semanales) presentan menos astenia y duermen mejor que los que no realizan ejercicio. Se recomienda la realización de ejercicios suaves, diarios, siendo los más adecuados los ejercicios aeróbicos ligeros: caminar (paseos al aire libre), bicicleta estática o natación. En función de la situación general, de la edad y de la presencia de otras patologías concomitantes se valorará el ejercicio más apropiado.
2) Control Nutricional adecuado: Muchos pacientes pierden peso, La ingesta de las calorías necesarias, así como los líquidos, proteínas y otros alimentos ayudan a prevenir la fatiga y a aumentar la energía.
3) Medidas psicosociales: La carga emocional asociada al cáncer puede agotar. Hay evidencia de que reduciendo la tensión, la ansiedad y la depresión se obtiene un efecto beneficioso sobre la fatiga. La consulta con el equipo de psico-oncólogos puede ayudar a disminuir la tensión acumulada y consecuentemente mejorar el cansancio.
Consejos para pacientes:
La realización de los siguientes consejos pueden ser útiles para disminuir el cansancio:
- Es muy importante conservar la energía, emprendiendo solamente las actividades más importantes en los momentos en los que se encuentre con más energía. Hacer una lista de las actividades que desea realizar, estableciendo prioridades.
- Sea realista sobre sus limitaciones y no sea duro consigo mismo. No sea demasiado tímido o demasiado orgulloso para solicitar y aceptar ayuda de los demás. Solicite ayuda y comparta o delegue tareas en familiares y amigos
- Es muy importante mantener una rutina diaria estructurada. Se recomienda llevar un diario de las actividades cotidianas.
- Utilice métodos para reducir el estrés: técnicas de relajación, meditación, oír música, oración, hablar con otras personas….
- Mejore la calidad del sueño: reduciendo el consumo de estimulantes (cafeína)
- Mantener un equilibrio diario entre actividad física y descanso, limite el tiempo en la cama al del sueño.
- Consultar si aparece dolor, depresión, insomnio.
- Lleve una dieta equilibrada, con un consumo diario de 2 litros de agua.
- Intente llevar una vida lo más normal posible.
TOXICIDAD DDIGESTIVA
1. NAUSEAS Y VOMITOS
Los avances realizados en el tratamiento quimioterápico y en el tratamiento de soporte han mejorado de forma importante la supervivencia y sobre todo la calidad de vida de los pacientes con cáncer.
A pesar del uso generalizado de pautas de tratamiento altamente eficaces en la prevención de las nauseas y vómitos inducidos por quimioterapia, este efecto adverso continúa presentándose en un porcentaje importante de pacientes (alrededor del 50%), dependiendo del régimen quimioterápico utilizado y de las características del paciente.
Las nauseas y vómitos continúan estando entre los efectos adversos de la quimioterapia que más ansiedad provocan en los pacientes, teniendo una gran repercusión sobre la calidad de vida y obligando, en algunos casos, a posponer, cambiar o suspender los tratamientos, debido a la aparición de complicaciones, como deshidratación, desequilibrio electrolítico, etc.
Los agentes antidiana producen escasas nauseas, perteneciendo todos los fármacos al grupo de mínimo riesgo emetógeno
Conceptos:
Es importante diferenciar entre las siguientes situaciones:
- Nauseas: sensación desagradable, subjetiva que se localiza en la parte posterior de la garganta y en el estómago, seguida o no del vómito.
- Vómitos: contracciones potentes de los músculos abdominales que hacen que el contenido del estómago sea expulsado de forma violenta por la boca.
- Arcadas: movimientos esofágicos y gástricos producidos para vomitar pero sin que haya expulsión del contenido.
Los criterios de toxicidad del NCI (National Cancer Institute) valoran la gravedad de las nauseas y de los vómitos inducidos.
Nauseas:
|
GRADO 1
|
Pérdida del apetito sin alteración en los hábitos alimentarios
|
|
GRADO 2
|
Disminución de la ingesta oral sin pérdida significativa de peso, deshidratación o desnutrición; e indica la administración de líquidos vía IV <24 hrs
|
|
GRADO 3
|
Consumo calórico oral o líquido inadecuado; líquidos administrados vía IV, alimentación por sonda, o indicada vía TPN ≥24 hrs
|
|
GRADO 4
|
Consecuencias potencialmente mortales
|
Vómitos:
|
GRADO 1
|
1 episodio en 24 hrs
|
|
GRADO 2
|
2-5 episodios en 24 hrs; se indica la administración de líquidos administrados vía IV <24 hrs
|
|
GRADO 3
|
≥6 episodios en 24 hrs; se indica la administración de líquidos vía IV, o TPN ≥24 hrs
|
|
GRADO 4
|
Consecuencias potencialmente mortales
|
Causas
La causas principal de las nauseas y los vómitos está relacionada con la toxicidad producida por los tratamientos quimioterápicos o la radioterapia aplicada sobre la región gastrointestinal, hepática o cerebral. No solo influyen los tratamientos administrados, determinadas características de los pacientes determinan una mayor predisposición a presentar nauseas o vómitos:
- Incidencia y severidad de nauseas o vómitos en quimioterapias previas
- Alcoholismo (menor frecuencia)
- Edad (más frecuentes en jóvenes)
- Sexo (más frecuentes en mujeres)
- Desequilibrios hidroelectrolíticos (hipercalcemia, deshidratación...)
- Invasión o crecimiento tumoral en región gástrica, hígado o cerebro
- Estreñimiento
- Fármacos asociados (opioides)
- Infecciones concomitantes
- Alteraciones del estado de ánimo: depresión, ansiedad, miedo
Tipos de nauseas y vómitos
1. Náuseas y vómitos agudos: Aparecen desde los primeros minutos de la quimioterapia hasta las 24 horas después del tratamiento. El pico de máxima incidencia y severidad es en las primeras 4-8 horas.
2. Nauseas y vómitos diferidos o retardados: Ocurren a partir de las 24 horas de administración de la quimioterapia. Su incidencia es aún mayor que los agudos y, por lo general, aparecen después de que el paciente ha abandonado el hospital y se encuentra en su domicilio. Incluso con un tratamiento correcto en la fase aguda, aparece en cerca de un 40% de los pacientes. En esta fase diferida el personal sanitario no siempre conocen bien el alcance real del problema, ya que los pacientes no suelen comunicar los acontecimientos adversos producidos cuando han salido del hospital. Su incidencia y severidad máxima aparece entre las 48 y 72 horas, pudiendo durar hasta 6-7 días.
3. Nauseas y vómitos anticipatorios: Aparecen en pacientes que han presentando nauseas y/o vómitos severos durante ciclos previos de quimioterapia. Se cree que los mecanismos de producción encajan en un modelo de aprendizaje, en donde estímulos como los visuales, sonoros e incluso los olores de la clínica, o la propia ansiedad, pueden servir como factor desencadenante. Casi un 30% de pacientes en tratamiento quimioterápico los presenta. Una vez establecidas, son difíciles de controlar, por ello es imprescindible controlar adecuadamente las nauseas y vómitos agudos y diferidos desde el primer ciclo.
NAUSEAS Y VÓMITOS SEGÚN LOS DIFERENTES TRATAMIENTOS
La quimioterapia y la radioterapia son las causas más comunes de náuseas y vómitos (emesis) en pacientes en tratamiento de cáncer.
No todos los fármacos quimioterápicos producen nauseas o vómitos. Los fármacos quimioterápicos se agrupan en 4 niveles de intensidad, en función de la probabilidad que tienen de producir nauseas o vómitos si no reciben un tratamiento adecuado para evitarlos o prevenirlos. Estos niveles nos orientaran sobre el tratamiento antiemético que se debe administrar.
- Riesgo alto: más de 90% de incidencia de nauseas y vómitos si no administramos un tratamiento antiemético (contra los vómitos). Por ejemplo en los esquemas con cisplatino.
- Riesgo moderado: nauseas y vómitos en el 30-90% de los pacientes. Carboplatino, Oxaliplatino …
- Riesgo bajo: Nauseas y vómitos en el 10-30% de los pacientes. Paclitaxel, Docetaxel, Etoposido, Topotecan, Pemetrexed, Gemcitabina…
- Riesgo mínimo: Menos del 10% de los pacientes presentarán nauseas y/o vómitos si no reciben un tratamiento adecuado. Bevacizumab, Erlotinib, Gefitinib, Cetuximab, Vinorelbina…
Además, hay que tener en cuenta que la mayoría de los tratamientos oncológicos son esquemas que combinan varios fármacos quimioterápicos, por lo que el riesgo de emésis (posibilidad de presentar vómitos) se ve incrementado. Ya hemos comentado que, no solo influyen los tratamientos administrados, determinadas características de los pacientes determinan una mayor predisposición a presentar nauseas o vómitos (sexo femenino, emesis postquimioterapia previamente , edad joven, emesis en el embarazo).
Entre los diferentes esquemas quimioterápicos empleados en el tratamiento del cáncer de pulmón, aquellos que contienen cisplatino, se caracterizan por ser altamente emetógenos, por lo que su oncólogo le informará de ello y le pautará el tratamiento adecuado para su prevención.
La RADIOTERAPIA también puede causar
náuseas y
vómitos, especialmente en los pacientes que reciben radioterapia dirigida al
tracto gastrointestinal, el
hígado o el cerebro. El riesgo de sufrir de náuseas y vómitos aumenta a medida que aumenta la
dosis de
radiación y el tamaño del área que se trata. Las náuseas y los vómitos causados por la radioterapia habitualmente se presentan entre media hora o varias horas después del tratamiento. Los días que no recibe radiación puede tener menos
síntomas.
MANEJO DE LAS NAUSEAS Y LOS VOMITOS
Las nauseas y vómitos leves pueden ser bastante molestos, pero en general no provocan problemas graves. Los vómitos graves (abundantes y frecuentes) pueden causar deshidratación, desequilibrio electrolítico (pérdida de los minerales que hay en el cuerpo, como el sodio y el potasio), pérdida de peso y depresión. Además, los vómitos graves, pueden provocar que algunos pacientes abandonen el tratamiento quimioterápico.
La mejor manera de controlar las nauseas y los vómitos inducidos por los tratamientos, es prevenir su aparición. Disponemos de fármacos eficaces en la prevención de los vómitos, también útiles para prevenir las nauseas, aunque algunos pacientes pueden presentar nauseas resistentes a los tratamientos, sin llegar a presentar vómitos, siendo estos más difíciles de eliminar.
Para poder adecuar el tratamiento a sus necesidades reales en muy importante conocer el grado y la gravedad de las nauseas y vómitos que ha padecido, como mínimo necesitamos conocer , al menos durante los 5 días posteriores a la quimioterapia, cuantos episodios de nauseas y vómitos ha tenido, es recomendable recoger estos datos en un diario de síntomas, que le entregará a su oncólogo en la siguiente visita. También es importante, saber si ha precisado medicación “extra” , por no ser suficiente con la medicación pautada. Estas dosis extras, se denominan “fármacos antieméticos de rescate”, y su función es aliviar las nauseas/vómitos si no se ha conseguido con los tratamientos pautados inicialmente.
Hoy en día disponemos de tres grandes grupos de fármacos antieméticos, que combinados entre ellos, son muy efectivos:
- Antagonistas de la serotonina: conocidos también como “setrones”. Los efectos secundarios más frecuentes son el dolor de cabeza y el estreñimiento.
- Inhibidores del receptor NK-1: Se administran conjuntamente con corticoides e inhibidores de la serotonina. Producen astenia, hipo y el malestar gástrico.
- Corticoides: Entre sus efectos secundarios destaca la excitación, el insomnio o el aumento del apetito.
Para el control óptimo, se instaurarán combinaciones de fármacos antieméticos que controlen los diferentes tipos de vómitos. Estas combinaciones variaran en función del poder emetógeno del tratamiento quimioterápico:
A. Quimioterapia altamente emetógena: Se combinará un antagonista de la serotonina, inhibidor del receptor NK-1 y corticoides para prevenirla fase aguda. En la retardada, la combinación del inhibidor del receptor NK-1 y corticoides es de elección.
B. Quimioterapia moderadamente emetógena: Combinar un inhibidor de la 5-HT3 y corticoides, con o sin inhibidor del receptor NK-1. En la fase retardada, los corticoides o un antiserotorinérgico pueden ser utilizados.
C. Quimioterapia poco emetógena: Un corticoide solo puede ser suficiente, así como un antiserotorinérgico.
El tratamiento antiemético (fármacos para prevenir y tratar las nauseas y vómitos) se pautará antes de iniciar el tratamiento quimioterápico y se mantendrá durante todo el tiempo que exista riesgo de emesis.
Además de los tratamientos farmacológicos, se recomienda en casos resistentes, consultar con el equipo de psico-oncólogos para el aprendizaje de técnicas de relajación y conductuales que junto con la medicación puede ayudarle a controlar las nauseas y los vómitos.
Existen “terapias alternativas” que aunque no tengan el apoyo de la evidencia científica pueden ser de utilidad en algunas pacientes: acupuntura, acupresión, musicoterapia, técnicas de relajación… Entre ellas, la acupuntura y la acupresión, actuando ambas sobre el punto P6 (un poco más debajo de la muñeca) parecen de utilidad en el control de los vómitos agudos, no mejorando las nauseas.
CONSEJOS UTILES
Si tiene nauseas o incluso vómitos pese al tto pautado, comuníqueselo a su oncólogo, que puede recomendarle otra medicación para reducir las nauseas y los vómitos y ayudar a prevenir la aparición en los ciclos próximos. Es muy importante contactar con su equipo de oncólogos si no puede ingerir alimentos o agua debido a las nauseas intensas o los vómitos, también si los síntomas empeoran a lo largo del tratamiento.
A continuación le ofrecemos algunos consejos útiles para controlar las nauseas y los vómitos producidos por el tratamiento:
- Es conveniente relajarse antes del tratamiento, puede ayudarle a sentir menos nauseas. Pruebe con: ejercicios de respiración profunda, escuchar música, imaginar escenas que le hagan sentir bien…
- Se recomienda comer antes del tratamiento de quimioterapia, no tiene que administrarse el tratamiento en ayunas. Tome un desayuno ligero si la sesión es por la mañana, o bien una comida ligera (no alimentos pesados, ni ricos en grasa), si la sesión de quimioterapia es por la tarde.
- No es necesario beber ni comer en exceso antes de cada ciclo.
- Los tratamientos quimioterápicos se administran en el hospital de día de oncología, y en ocasiones duran varias horas. Se recomienda llevar comidas ligeras o refrigerios.
- Coma en un lugar agradable y ventilado. Mantenga un ambiente tranquilo a la hora de la comida
- Coma despacio
- Mastique bien los alimentos
- Haga comidas ligeras y evite las abundantes. Es preferible repartir la comida en varias tomas de pequeña cantidad.
- No se fuerce a comer. Elija alimentos que le resulten agradables.
- Aproveche para comer los momentos en que tenga hambre (habitualmente el desayuno): la pérdida de apetito es frecuente los días posteriores al tratamiento. Tranquila, en unos días recuperará el apetito.
- Tome líquidos antes de las comidas, disminuya la ingesta de líquidos durante las comidas para tener menor sensación de plenitud.
- Evite los alimentos grasos, fritos o muy dulces. Tolerará mejor los alimentos a temperatura ambiente
- Si nota sabor metálico a los alimentos, puede disminuirlo con especias, que mejorarán el sabor.
- No se tumbe después de comer, es mejor permanecer sentada en un sillón unas dos horas.
- Use ropa suelta, evite apreturas (cinturones,…)
- Si tiene nauseas por la mañana, coma antes de levantarse, le vendrá bien tener en la mesilla de noche algún alimento seco como galletas, tostadas o pan.
- Chupar caramelos blandos sin azúcar, chicle sin azúcar con xilitol puede ayudar a estimular la producción de saliva haciendo más agradable la comida posterior. Se pueden sustituir por trozos de piña natural
- Mantenga una correcta higiene bucal, limpie los dientes trascada vómitos.
- No consuma bebidas alcohólicas, ni tabaco y limite las bebidas gaseosa, durante el tratamiento pues favorecen las nauseas.
- Pida ayuda a familiares y amigos para realizar las compras de alimentos y preparar las comidas.
- Además de los tratamientos farmacológicos, se recomienda en casos resistentes, consultar con el equipo de psico-oncólogos para el aprendizaje de técnicas de relajación y conductuales que junto con la medicación ayude a controlar las nauseas y los vómitos.
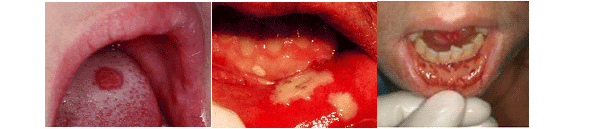
2. MUCOSITIS
La mucositis se trata de la inflamación de la mucosa del tracto digestivo, extendiéndose desde la boca hasta el ano. Es un efecto secundario muy frecuente, apareciendo hasta en un 35-40% de los pacientes que reciben quimioterapia. Tiene una gran incidencia en pacientes transplantados de médula ósea (76%), y en los que reciben radioterapia, siendo su incidencia cercana al 100% cuando reciben radioterapia sobre la cavidad oral.
Además del empleo de quimioterápicos, son factores de riesgo para su desarrollo: boca mal cuidada, la existencia de patología dental (caries, patología periapical o enfermedad periodontal), el tratamiento de radioterapia concomitante y la presencia de neutropenia.
Se manifiesta principalmente con enrojecimiento y/o úlceras de mucosas. Inicialmente suele aparecer sequedad bucal y sensación quemante, y pueden evolucionar a dolor severo (si aparecen grandes úlceras).
La mucositis puede aparecer en cualquier mucosa del cuerpo: boca (estomatitis), esófago (esofagitis), intestino (enteritis), recto (proctitis) y mucosa genital. Predispone a la aparición de infecciones secundarias (sobretodo en pacientes con neutropenia) así como dificultad para la alimentación.
Dependiendo del momento de la aparición, las mucositis tienen dos mecanismos diferentes de producción:
- Mucositis por toxicidad directa de los quimioterápicos sobre las células de la capa basal epitelial de las mucosas. Aparece entre la segunda y tercera semana del tratamiento.
- Mucositis por toxicidad indirecta, producida por el efecto citotóxico de la quimioterapia sobre la médula ósea. Coincide con el nadir de la quimioterapia (7-14 días postquimio), se asocia a neutropenia y su recuperación va asociada al aumento de las cifras de leucocitos.
Suele autolimitarse en el tiempo, siendo la duración media de 14 días. El principal problema es la dificultad que puede aparecer a la hora de alimentarse, puede notar que los alimentos le raspen detrás del pecho, haciendo en ocasiones muy dolorosa la ingesta de alimentos, siendo necesaria la administración de sueros que aseguren la correcta hidratación y nutrición.
La gravedad de la mucositis viene dada por los criterios de toxicidad de NCI (National Cancer Institute):
|
Grado 0
|
No mucositis
|
|
Grado 1
|
Eritema, dolor moderado, úlceras no dolorosas
|
|
Grado 2
|
Eritema con edema y úlceras dolorosas pero que permiten la ingesta oral
|
|
Grado 3
|
No es posible la ingesta oral
|
|
Grado 4
|
Requiere nutrición enteral o parenteral
|
Tratamiento:
El tratamiento recomendado es:
- Higiene bucal adecuada.
- Enjuagues con anestésicos tópicos (Lidocaína viscosa, Benzocaína, solución de Difenhidramina).
- Fármacos que recubren la mucosas (enjuagues con soluciones antiácidas)
- Vitamina E: 200-400mg /día
- Analgésicos orales, siendo en ocasiones necesario el empleo de mórficos
- En paciente con candidiasis oral, enjuagues con nistatina tópica o Antifúngicos orales. No utilizar bicarbonato ni clorhexidina por interaccionar con los Antifúngicos.
Consejos para pacientes:
- Higiene bucal adecuada: Utilización de cepillo suave y realizar enjuagues orales con colutorios (solución salina 0.9%, bicarbonato sódico, evitar colutorios con alcohol).
- Previo al inicio del primer ciclo de quimioterapia se debería realizar una revisión de la cavidad oral y de las piezas dentales, para detectar posibles alteraciones y disminuir sus complicaciones durante el tratamiento.
- Hidratación de los labios (aceite de oliva, cremas labiales). En caso de sangrado, utilizar bastoncillos de algodón.
- Evitar alimentos ácidos, fritos, amargos, picantes, muy salados o muy condimentados. Evitar los alimentos calientes
- Evitar verduras crudas, frutas verdes, bebidas gaseosas
- Consuma una dieta líquida o semilíquida y aumente el consumo de líquidos.
- Tomar preferentemente alimentos blandos o triturados
- Si el paciente tiene una ingesta escasa, valorar añadir alimentos proteicos (queso, clara de huevo, pollo) grasos (mantequilla, aceite, nata) e hidratos de carbono (miel, zumos).
- Los suplementos de glutamina parece disminuir la mucositis secundaria a radioterapia.
- La crioterapia podría ser beneficiosa: masticar hielo unos minutos antes de la quimioterapia
- Si utiliza prótesis dentaria, es aconsejable usarla solo durante las comidas.
- Comentar con su Oncólogo en caso de dolor intenso que impide ingesta.
3. DIARREA
Se trata de una complicación frecuente en pacientes que reciben quimioterapia. Puede producir tanto disminución de la calidad de vida del paciente como complicaciones médicas importantes por depleción de volumen y alteraciones electrolíticas. Su severidad se evalúa en función del número de deposiciones/ día, la presencia de deposiciones nocturnas, la necesidad de tratamiento intravenoso y la presencia de de moco y/o sangre en las heces.
Los criterios de toxicidad del NCI (National Cancer Institute), valoran la gravedad de la diarrea:
|
GRADO O
|
No diarrea
|
|
GRADO 1
|
Aumento del número de deposiciones sin exceder 4 episodios/día
|
|
GRADO 2
|
Aumento del número de deposiciones entre 4-6 episodios/día, presentación nocturna
|
|
GRADO 3
|
Más de 7 deposiciones/día, incontinencia, signos de deshidratación, necesidad de hidratación intravenosa
|
|
GRADO 4
|
Signos de deshidratación severa con repercusión hemodinámica
|
La diarrea producida por los agentes antidiana, especialmente inhibidores de la tirosin-kinasa (Cetuximab, Lapatinib, Gefitinib y Erlotinib) es consecuencia del daño producido a nivel de la mucosa del intestino delgado y del colon, produciendo un exceso de fluidos secretados en la luz intestinal. Se trata de una toxicidad limitante de dosis, y se potencia con la asociación de otros fármacos quimioterápicos, como es el caso de la combinación de cetuximab con Irinotecan para el cáncer colorrectal.
Tratamiento
El tratamiento a realizar va a depender del grado de severidad de la diarrea así como de la presencia de factores de riesgo: fiebre, vómitos, neutropenia, sangrado franco en la deposición, dolor abdominal moderado/severo, deshidratación.
Los pacientes con diarrea leve y sin factores de riesgo pueden ser tratados ambulatoriamente con medidas farmacológicas y antidiarreicos orales mientras que los que presentan diarrea grave y/o factores de riesgo necesitarán tratamiento hospitalario.
Medidas farmacológicas:
- Loperamida: El régimen habitual consiste en una dosis inicial de 2 cápsulas juntas y posteriormente 1 cápsula cada 2-4 horas ó después de cada deposición hasta un máximo de 8 cápsulas/día, manteniendo el tratamiento hasta que cedan las diarreas durante 12 horas. Algunos autores recomiendan añadir tratamiento con una Fluorquinolona oral durante siete días cuando la diarrea persiste más de 24 horas a pesar del tratamiento con Loperamida
- Octreotide: Se trata de un análogo sintético de la somatostatina. Su mecanismo de acción es a través de la disminución de la secreción intestinal y prolongando el tránsito intestinal. Se utiliza a dosis de 100-150 mcg por vía subcutánea tres veces al día
Consejos para los pacientes:
- Evitar alimentos con lactosa, cafeína, bebidas con gas, alimentos grasos, alimentos ricos en fibra.
- Ingerir abundantes líquidos (agua con azúcar y sal, Sueroral®).
- Dieta astringente, con manzana, plátano, arroz.
4. ESTREÑIMIENTO
Es la complicación intestinal más frecuente de los pacientes con cáncer y tratamiento quimioterápico. Consiste en la disminución del número de deposiciones (menos de dos veces a la semana), asociado a mayor dureza de las heces.
Se da con mayor frecuencia en mujeres, con una mayor incidencia en los pacientes con tratamiento analgésico con opiáceos y con los fármacos habitualmente empleados para prevenir o tratar las nauseas y vómitos. La disminución del ejercicio físico y las deficiencias nutricionales también favorecen a la aparición de estreñimiento.
Tratamiento
Es necesario establecer unas correctas medidas higiénico-dietéticas (dietas ricas en fibras y frutas, ingesta abundante de líquidos, ejercicio físico ligero), y si esto no lo soluciona consultar con el oncólogo médico que pautará medidas terapéuticas con laxantes.
Medidas farmacológicas:
- Agentes formadores de masa: Salvado de trigo, metilcelulosa, Plantago Ovata. Primer tratamiento asociado a abundante agua.
- Laxantes vía rectal: Glicerol, Enema Casen, Micralax Ablandan las heces y las lubrifican. Tratamiento a corto plazo del estreñimiento. No adecuado como tratamiento único.
- Laxantes emolientes: Parafina. Hidratan y ablandan las deposiciones. Latencia de 6-12 horas
- Laxantes Osmóticos: retienen agua en la luz intestinal. Período de latencia de uno a dos días. Lactulosa y Lactitol.
- Laxantes estimulantes: Aumentan el peristaltismo intestinal. Período de latencia de 6-12 horas. Están contraindicados si se sospecha obstrucción intestinal. Ej. Senósidos. Bisacodilo.
En estreñimientos pertinaces es necesario combinar laxantes de mecanismo de acción diferente (Ej. Parafina + senósidos + osmóticos)
Consejos para los pacientes:
- Tomar alimentos ricos en fibras y abundante agua.
- Realizar ejercicio físico moderado diariamente (caminar), así aumenta el movimiento intestinal.
- Intentar ir a una hora fija al baño, con el fin de educar el intestino.
5. ESOFAGITIS
Producida por el efecto tóxico de la quimioterapia sobre la mucosa del esófago (ver mucositis). Aparece a la semana del tratamiento como dolor centrotorácico (retroesternal) y odinofagia (dolor al tragar los alimentos o la saliva), en ocasiones su severidad impide la nutrición adecuada, precisando los pacientes ingreso hospitalario para nutrición parenteral.
Frecuentemente aparece asociada a la neutropenia (ver neutropenia), siendo más intensa y presentando un mayor riesgo de infección por hongos (cándidas).
6. PERFORACION INTESTINAL
Los inhibidores de la angiogénesis (Bevacizumab), aumentan el riesgo de perforación intestinal (gástrica, intestino delgado o colon).
Se manifiesta por dolor abdominal agudo, por lo que es imprescindible la exploración meticulosa y repetida del paciente con dolor abdominal que está siendo tratado con antiangiogénicos para descartar la presencia de un abdomen agudo.
Existen una serie de factores de riesgo, que aumentan la probabilidad de que se produzca una perforación intestinal:
- Uso de antiinflamatorios
- Enfermedad inflamatoria crónica
- Presencia de úlcera gastroduodenal
- Cirugía abdominal reciente
- Radioterapia abdominal previa
- Cuadro oclusivo secundario a crecimiento tumoral.
Tratamiento
Ante la sospecha se debe interrumpir inmediatamente el tratamiento, realizando una exploración física meticulosa, manteniendo al paciente en dieta absoluta con una correcta hidratación y analgesia. Valorar si hay indicación quirúrgica.
7. HIPERTRANSAMINASEMIA
Los antiangiogénicos (tanto los inhibidores de la Tirosin-Kinasa del VEGFR como los anticuerpos monoclonales anti-VEGF), pueden producir elevación de cifras de transaminasas, y a veces, hepatotoxicidad limitante de dosis.
El mecanismo fisiopatológico no está totalmente estudiado, pero ante cualquier grado 3 o 4 de hipertransaminasemia es obligatorio interrumpir el tratamiento, casi siempre son hipertransaminasemias reversibles, y en caso de proseguir el tratamiento se requerirá reducción de dosis del fármaco causante.
FIEBRE Y REACCIONES ALÉRGICAS
1. FIEBRE
La fiebre puede aparecer como efecto secundario directo de los fármacos administrados, o asociada a una infección producida por el descenso de la cifra de neutrófilos secundaria a la quimioterapia, siendo esta la causa más frecuente de fiebre en los pacientes en tratamiento con quimioterapia (ver neutropenia).
Habitualmente, la fiebre secundaria a fármacos ocurre en las primeras horas tras la administración y desaparece rápidamente. En otras ocasiones, sin embargo, la fiebre ocurre a partir de las 48 horas tras la administración del fármaco y dura varios días, lo que dificulta la distinción de otras causas, y conlleva la administración empírica de antibióticos, la realización de pruebas diagnósticas innecesarias y aumenta el riesgo de repetidas administraciones del medicamento en el caso de no haberlo identificado
En la mayoría de los casos la fiebre inducida por quimioterapia aparece por un mecanismo de hipersensibilidad mediado por inmunoglobulinas E (IgE), aunque a veces la droga induce directamente la degranulación del mastocito con la subsiguiente liberación de mediadores.
Las manifestaciones clínicas pueden ser similares a las de las reacciones alérgicas, con aparición posterior de manifestaciones cutáneas (exantema generalizado o exantema fijo).
La fiebre secundaria a fármacos, no responde al tratamiento con antibióticos, desapareciendo con la suspensión del tratamiento y con corticoides (lo que sugiere su origen inmunológico/alérgico).
2. REACCIONES ALERGICAS O DE HIPERSENSIBILIDAD
Conocidas también como Reacciones infusionales, aparecen durante la infusión del tratamiento y consisten en la aparición de fiebre y escalofríos, asociándose en ocasiones a nauseas, vómitos, cefalea, dolor en la zona tumoral, rigidez, disnea, rash y astenia.
Frecuentes durante la infusión de Anticuerpos monoclonales, Rituximab Trastuzumab y Cetuximab. Suelen aparecer entre los 30 y los 120 minutos del inicio de la infusión y se resuelven disminuyendo la velocidad de la perfusión o interrumpiéndola, precisando en casos excepcionales (reacciones anafilácticas) medidas de soporte farmacológico.
Se producen por la sensibilización inmunológica frente al fármaco recibido previamente. Aunque son muy frecuentes, sólo una pequeña proporción de individuos presenta manifestaciones clínicas. Generalmente existe un periodo de latencia, tras la exposición previa, aparecen los síntomas con la reexposición del fármaco inmediatamente (incluso con dosis mínimas), en forma de urticaria.
Las formas clínicas más frecuentes de presentación por orden de frecuencia son:
- Exantema: Aparición de pequeñas pápulas que van confluyendo hasta formar placas generalizadas. El estado general es bueno y la resolución rápida.
- Eritema fijo pigmentario: Placa eritematosa redondeada, que a las pocas horas evoluciona a una ampolla central que se rompe. Cura en 2-3 semanas, dejando una pigmentación violácea persistente.
- Urticaria: Pápulas eritematosas y edematizadas o habones, asociadas a prurito intenso. En ocasiones se asocia a angioedema, asociando el paciente dificultad respiratoria aguda.
- Otras: Hiperpigmentaciones, erupciones acneiformes o eczematosas, psoriasis, vasculitis, reacciones de hipersensibilidad, fotosensibilidad.
- Anafilaxia: Aparición de disnea (sensación de ahogo), flushing (enrojecimiento facial) y dolor torácico.
Tratamiento
Inicialmente se procederá a la retirada del fármaco responsable, lo que produce mejoría del proceso. La supresión definitiva del fármaco dependerá de la gravedad y la evolución de la reacción. En caso de que sea necesario mantener el fármaco responsable, y siempre que la reacción no haya sido grave, se puede mantener, observando la evolución clínica durante 24-48 horas.
Tratamiento farmacológico:
Los casos leves se resuelven con tratamiento sintomático, antihistamínicos y corticoides tópicos. Controlar al paciente en las siguientes 24-48 horas, para descartar la progresión hacia formas de mayor gravedad.
Los casos graves, precisan hospitalización y en algunos casos ingreso en unidades de cuidados intensivos, con medidas de soporte vital, cuidado de mucosas y tratamiento con corticoides intravenosos.
TOXICIDAD CUTÁNEA
Pueden aparecer manifestaciones locales o generalizadas en piel y anejos cutáneos (uñas, folículos pilosos) que aunque no amenazan la vida de los pacientes tienen un gran impacto en su calidad de vida, al alterar la percepción de la imagen corporal.
Los nuevos fármacos antidiana se asocian a un amplio abanico de toxicidades cutáneas, especialmente los inhibidores de la tirosin-kinasa. Los efectos secundarios dermatológicos generalmente corresponden a erupciones acneiformes (aproximadamente 85%), aunque también xerosis (12%-16%), paroniquia, eccema, fisuras, telangiectasias, hiperpigmentación, cambios en el cabello, y granuloma piógeno. La inhibición del EGFR podría aumentar la sensibilidad de la piel frente a la radiación ultravioleta, lo que explica la frecuente localización del exantema en zonas fotoexpuestas o fotodañadas, como cara (82%) y tórax en zona del escote (64%).
Se ha observado que la toxicidad cutánea derivada del uso de los inhibidores de la tirosin-kinasa parece estar relacionada con la respuesta tumoral y la supervivencia del paciente, por lo tanto la aparición de rash y su severidad podría ser un marcador predictivo de la eficacia de estos fármacos.
1. TOXICIDAD LOCAL:
Flebitis: Consiste en la inflamación de la pared interna de una vena. Puede acompañarse o no de la trombosis de la misma. Algunos agentes quimioterápicos predisponen a su aparición. Rápidamente se siente sobre la vena un dolor localizado, hinchazón y eritema, y la zona se nota caliente. Debido a que la sangre de la vena está coagulada, ésta se siente como una cuerda dura debajo de la piel. Esta sensación puede abarcar toda la longitud de la vena.
Por lo general, la flebitis desaparece por sí sola. La administración de un analgésico, como la aspirina o el ibuprofeno, alivia el dolor. Aunque la flebitis mejora en cuestión de días, pueden pasar varias semanas antes de que las irregularidades de la vena y la sensación de dolor desaparezcan por completo. Se puede, (en los casos más dolorosos) inyectar un anestésico local. En función de los fármacos administrados las medidas locales, como el calor o el frío pueden aliviar las molestias.
Extravasación: ocurre cuando los fármacos quimioterápicos entran en contacto directo con los tejidos circulantes durante su infusión intravenosa. La gravedad el cuadro depende del fármaco y de su concentración. Así hay quimioterápicos que producen una reacción inflamatoria local o flebitis dolorosa, y otros pueden llegar a causar destrucción de los tejidos (necrosis tisular), con acúmulo del fármaco, lo que puede dar lugar a una lesión crónica que en ocasiones se ulcera llegando a dañar músculos y nervios.
En los casos de extravasación hay que avisar al personal de enfermería inmediatamente que interrumpirá la administración de quimioterapia, aspirará la medicación que quede en el catéter y procederá a su retirada y a la elevación de la extremidad afectada. En la mayoría de los casos se aplicará frío local (excepto los alcaloides de la vinca que mejoran con el calor local) y los antídotos recomendados en función del fármaco extravasado. Ante lesiones persistentes o con necrosis o ulceración se recomienda consultar con los servicios de dermatología y cirugía plástica.
2. DERMATITIS
En ocasiones aparecen fenómenos de fotosensibilización, descamación, hiperpigmentación (puede aparecer en el trayecto de las venas en las que se administra la quimioterapia) y dermatitis palmo-plantar o síndrome mano-pie.
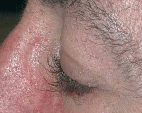
3. ERITRODISESTESIA PALMOPLANTAR
Se presenta inicialmente como disestesias en palmas y plantas (alteraciones sensitivas, hormigueos) seguido de edema y un eritema simétrico, intenso y bien delimitado. Progresa a descamación, ulceración, infección y pérdida de función. Afecta inicialmente a palmas de manos y pies. Puede llegar a superficie dorsal de extremidades, región inguinal y axilar, labios, incluso genitales. Aparece normalmente tras 2-3 ciclos de tratamiento. Se trata interrumpiendo o disminuyendo el fármaco implicado. También se pueden usar corticoides y piridoxina con resultados variables. Suele curar en 2-4 semanas tras finalizar el tratamiento.
Recomendaciones para pacientes:
- Mantenerse en lugares frescos.
- Remojar pies y manos con agua fría.
- No usar agua muy caliente para ducharse o lavarse las manos, o lavar platos.
- Utilizar ropa ancha y calzado cómodo.
- No hacer ejercicios intensos, especialmente los días siguientes a la infusión.
- Evitar el sol directo
Imágenes de diferentes grados de Eritrodisestesia palmoplantar

4. TOXICIDAD UNGUEAL
Las uñas se ven afectadas con mucha frecuencia, pareciendo onicodistrofia (alteración del color y del crecimiento de las uñas) y onicolisis (destrucción de la uña), generalmente se relacionan con la dosis acumuladas de los fármacos así como con el tiempo de tratamiento. Pueden aparecer también áreas de pigmentación en líneas o bandas.
Perionixis y Paroniquia: Inflamación dolorosa del tejido periungueal. Aparece eritema con descamación alrededor de los dedos, acompañado de dolor y formación de pequeñas fisuras. Aunque su etiología no es infecciosa, de forma secundaria puede ocurrir una impetiginización. Se afectan sobre todo los dedos de las manos y con menor frecuencia los dedos de los pies. Suele ocurrir después de la primera quincena de tratamiento. Se tratará a estos pacientes con crema de corticoides para el eritema.
5. ALTERACIONES DEL CABELLO
Alopecia
Se produce en toda la superficie corporal y sobre el 90% del vello en fase de crecimiento. Comienza a las 2-3 semanas del tratamiento, siendo máxima a los dos meses y recuperándose a partir de los 3-6 meses del cese de la quimioterapia. En ocasiones el nuevo cabello es de características diferentes.
El grado de alopecia dependerá del esquema quimioterápico empleado, las dosis de los fármacos y la vía de administración.
No existen fármacos que prevengan su aparición, el empleo de medios físicos como los gorros hipotérmicos que producen vasoconstricción superficial del cuero cabelludo han demostrado alguna eficacia.
La información previa, el apoyo psicológico, la no utilización de tintes ni secadores, y evitar la exposición solar son algunas de las medidas recomendadas a los pacientes.
Otras alteraciones
Los Inhibidores de la Tirosin-Kinasa, producen alteraciones en la cantidad y calidad del cabello. Las alteraciones del pelo se ven a los dos-cinco meses. Las anormalidades en el crecimiento del cabello dependen del tipo de pelo y de su ubicación, observándose alopecia, fragilidad y disminución del crecimiento en cuero cabelludo y piernas; en cambio, hipertricosis y aumento del grosor del pelo en cara.
Existen adelgazamiento, ondulación y fragilidad del pelo de la barba y cuero cabelludo. Crecen las pestañas y también se ondulan (tricomegalia). Las cejas se vuelven gruesas y más rígidas.
No hay tratamiento adecuado. Para el aumento de vello facial puede realizarse depilación y, en el caso de tricomegalia, pueden cortarse las pestañas. La tricomegalia se puede resolver al mes de terminada la terapia.
Puede aparecer decoloración del cabello en pacientes tratados con Imatinib, Sorafeniby Pazopanib.
6. FOTOSENSIBILIZACIÓN
Algunos fármacos quimioterápicos producen reacciones de fototoxicidad y fotoalergia (reacciones de hipersensibilidad que surgen con la exposición solar). Se recomienda a los pacientes no exponerse a las radiaciones solares en las horas de máxima incidencia (mediodía) y emplear de forma generalizada la fotoprotección solar con filtros físicos (protectores pantalla) conteniendo óxido de titanio o zinc, talco o caolín.
7. ERUPCIONES CUTÁNEAS ACNEIFORMES o RASH
Incidencia aumentada desde la introducción de nuevos tratamientos, principalmente los anticuerpos monoclonales como el Cetuximab y los inhibidores de la tirosinkinasa Gefitinib y Erlotinib. El espectro de toxicidad cutánea es variado, la forma más común de presentación es la llamada reacción papulopustular o rash acneiforme, definida como una erupción dermatológica confinada fundamentalmente a zonas ricas en glándulas sebáceas como son: cara, cuello, zona retroauricular, espalda, parte superior de tórax y cuero cabelludo, pudiendo afectar a otras zonas pero siempre respetando las palmas de las manos y las plantas de los pies.Puede haber lesiones hemorrágicas y costrosas, predominantemente en nariz.
La erupción es de características similares independientemente del mecanismo de acción del fármaco y es dosis dependiente, si bien es cierto que tiende a ser más severa, más frecuente y extensa con los anticuerpos monoclonales.
La cronología de esta toxicidad pasa por distintas fases:
- Alteración sensitiva con eritema y edema (semana 0-1) en las zonas afectas.

- Erupción papulopustular (semanas 1-3)
- Fase de costra (semanas 3-5) y,
- Zona de eritemato-telangiectasia.
Normalmente el rash se resuelve en unas 4-6 semanas desde la aparición, quedando en la zona afecta una evidente sequedad cutánea
Se ha establecido una correlación significativa entre la aparición de acné y la eficacia del tratamiento, con una mayor probabilidad de respuesta en los pacientes que lo presentan.
La escala empleada para categorizar esta toxicidad es la del NCI-CTC V3. Se ha graduado su severidad en:
‒ Grado 0: no existe toxicidad.
‒ Grado 1: cuando afecta la cara y no se acompaña de síntomas
‒ Grado 2: igual que en 1 pero asociado a prurito y afectando un área inferior al 50% de la superficie corporal.
‒ Grado 3: cuando la erupción se extiende además de la cara, al tórax y la espalda o a más del 50% de la superficie corporal, o el desarrollo de lesiones confluentes, dolorosas, maculares, papulares, vesiculares descamativas
‒ Grado 4: en forma de una dermatitis exfoliativa generalizada y/o con presencia de úlceras.
Tratamiento:
Los tratamientos de las complicaciones dermatológicas deberían cumplir los siguientes requisitos: no interferir con el efecto antitumoral de los EGFRI, pocos efectos secundarios, fácil administración y alcanzar un rápido efecto para asegurar que el paciente continúe su tratamiento quimioterapéutico.
Medidas farmacológicas
Se aplicarán en función del grado de afectación cutánea:
Reacción acneiforme grado 1-2: lesiones locales, sin asociación con otros síntomas
Puede incluso no requerir tratamiento
Se recomienda lavado de las zonas afectadas con jabón antiséptico 2 veces al día (Sato detergente líquido®; Germisdin gel®, Bactopour®, Effaclar®).
Se pueden asociar Corticoides tópicos (Peitel crema®, Batmen crema®) por la mañana y eritromicina tópica (Loderm gel®* (2%), Eridosis®* (toallitas 2%)) por la noche.
Continuar el tratamiento a dosis habitual
Reacción acneiforme grado 2:
Además de los tratamientos anteriores se añadirá:
1. Antihistamínico tipo hidroxicina (Atarax®) 25 mg /8 horas (si el picor es muy intenso 50 mg/8 horas y si es muy leve, 25 mg/noche)
2. Doxiciclina 100 mg/24 horas o Minociclina 100 mg /24 h
Valorar a las dos semanas.
Reacción acneiforme grado 3: (generalizado, asociado con alteración de las actividades de la vida diaria, problemático para el paciente)
1. Doxiciclina 100 mg/12 horas o Minociclina 100 mg /12 h
Considerar el uso de pulsos cortos de corticoides sistémicos (Metilprednisolona).
También se puede suspender el medicamento por unos siete a 10 días y en ese período usar corticoides tópicos y Tetraciclinas orales.
Además hay que considerar el uso de Isotretinoína en dosis bajas (10 a 20 mg diarios) en los pacientes que no responden a las medidas previamente mencionadas. Hay que tener en cuenta que se puede exacerbar la xerosis y paroniquia
Reacción acneiforme grado 4:
Suspender el fármaco y trasladar a una unidad especializada.
Analgesia será útil en pacientes que refieren dolor. Es posible la sobreinfección estafilocócica, sugiriéndose cultivar y tratar.
Siempre hay que tener en cuenta que los efectos cutáneos secundarios a la administración de los inhibidores de la tirosin-kinasa son temporales y disminuyen en intensidad con las exposiciones posteriores.
Recomendaciones para pacientes:
- Evitar el daño provocado por luz ultravioleta
- Empleo de maquillaje corrector idealmente hipoalergénico, remover maquillaje con lociones adecuadas,
- Protector solar. Es conveniente utilizar el índice de protección máximo
- Emolientes para xerosis asociada
- Para la higiene diaria de la piel se recomienda el uso de geles de ducha o baño basados en aceites o preparados de avena y emplear agua tibia.
- Se recomienda el uso de cremas hidratantes (sin alcohol) dos veces al día en toda la superficie corporal.
8. XEROSIS
Aparece a las semanas del inicio del tratamiento y consiste en la sequedad de la piel o de la conjuntiva y otras membranas mucosas. Se localiza principalmente en brazos y piernas, comúnmente en áreas que han sido afectadas por la erupción acneiforme.
En manos y pies se puede desarrollar una pulpitis seca con aparición de fisuras y dolor en dedos
Tratamiento:
El tratamiento es preventivo.
Empleo de Urea al 5-10%
Consejos para pacientes:
- Evitar jabones irritantes y duchas largas. Se recomienda utilizar productos de higiene suaves, tipo aquellos formulados con avena o con aceites, y seguidamente aplicarse una crema corporal emoliente.
- Usar agua tibia.
- Evitar cremas muy oleosas, por el riesgo de foliculitis.
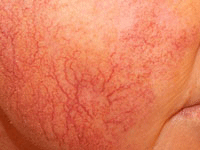
9. TELANGIECTASIAS
Las telangiectasias o arañas vasculares son dilataciones de
capilares pequeños y de los vasos superficiales, lesiones de color rojo brillante de 1-4 mm de diámetro que palidecen a la presión
. De predominio en la zona facial y en la zona superior del tórax. Se aconseja únicamente medidas de tipo maquillaje para disimular este tipo de lesión.
Puede empeorar con la exposición solar.
10. ALTERACIONES DEL COLOR DE LA PIEL Y EL CABELLO
La coloración, en ocasiones amarillenta de la piel originada por el color amarillo del fármaco activo y su metabolito. Se puede observar también coloración amarillenta de la orina.
Puede asociarse con despigmentación del cabello después de 5-6 semanas de tratamiento. Esto produce sucesiones de bandas despigmentadas y pigmentadas en el cabello coincidiendo con los periodos de tratamiento y de descanso.
TOXICIDAD RENAL Y DE LAS VIAS URINARIAS
Muchos de los fármacos quimioterápicos o sus metabolitos se eliminan total o parcialmente vía renal, y pueden producir lesiones en cualquiera de las estructuras que componen esta vía, no solo al nivel renal sino también en las vías urinarias, especialmente en la vejiga.
Para la prevención de esta toxicidad es fundamental asegurar una correcta hidratación durante los tratamientos, y ajustar las dosis de los quimioterápicos según la función renal (se evalúa con una analítica previa al tratamiento).
1. TOXICIDAD RENAL POR QUIMIOTERAPIA
El fármaco que se asocia principalmente a la insuficiencia renal aguda es el Cisplatino. Cerca del 35% de los pacientes desarrollan una insuficiencia renal leve y reversible tras el primer ciclo de quimioterapia con cisplatino. La incidencia y severidad puede incrementarse en los ciclos posteriores. Si no se controla de forma adecuada y sobretodo si no se previene su aparición, puede desarrollarse una toxicidad severa que desencadene un fracaso renal agudo, requiriendo diálisis. Aunque suele recuperarse, puede quedar algún grado de disfunción renal.
La mejor manera de controlar esta toxicidad es la prevención, para ello es necesaria la realización de analíticas previas que confirmen una buena función renal previa a la quimioterapia. Es recomendable beber al menos 2 litros de líquidos durante los 2 días siguientes a la quimioterapia y más de 1 litro la semana posterior.
Otros fármacos como el Metrotexate a dosis altas, requieren controles exhaustivos con hidratación forzada y alcalinización de la orina para impedir que precipiten y provoquen una necrosis tubular y una insuficiencia renal severa y una vez administrado el fármaco monitorizar sus niveles en sangre.
Entre los nuevos fármacos, el Trastuzumab puede producir una glomerulopatía, en forma de Síndrome nefrótico, que aparece entre los 4 y 18 meses después de haber iniciado el tratamiento, aunque es poco frecuente.
2. TOXICIDAD VESICAL
En ocasiones la quimioterapia puede producir daños en la vejiga urinaria, denominadas Cistitis, presentado los pacientes hematuria (orina con sangre), disuria (escozor o dolor al orinar). Son características las cistitis hemorrágicas asociadas a fármacos como la Ciclofosfamida o la Ifosfamida. Su tratamiento es la suspensión de la quimioterapia, hidratación, analgésicos y antiespasmódicos, cediendo el cuadro a los pocos días.
Lo mejor, es una vez más la prevención, aportando una hidratación suficiente y asociando Mesna (Uromitexan®), antídoto específico que inactiva los metabolitos tóxicos de los quimioterápicos impidiendo que se acumulen en la vejiga. Se administran 3dosis, una intravenosa antes de la quimioterapia seguida de 2 dosis orales a las 2 y a las 6 horas de la quimioterapia.
3. SINDROME HEMOLÍTICO-URÉMICO
Consiste en un fallo renal progresivo asociado a anemia hemolítica microangiopática (como consecuencia de la formación de los microtrombos, los glóbulos rojos ven dificultado su paso por los vasos sanguíneos y se destruyen) que aparece al menos 6 meses después de haber finalizado el tratamiento quimioterápico. Se detecta por el aumento progresivo de la cifra de creatinina sérica y la aparición de anemia.
4. PROTEINURIA
De forma extraordinaria, el uso de inhibidores de angiogénesis puede desembocar en un síndrome nefrótico o necesitar de hemodiálisis, pero objetivar proteinuria asintomática en los pacientes tratados con estas nuevas drogas no es infrecuente, sobre todo asociado al uso de Bevacizumab.
Se considera:
- Proteinuria grado 3: proteinuria mayor a 3.5 g/24 horas
- Proteinuria grado 4: síndrome nefrótico
En la práctica diaria, los pacientes que estén siendo tratados con Bevacizumab requieren monitorización mensual de su proteinuria en orina de 24 horas, de manera que ante aumento progresivo de la proteinuria es necesario la reducción de la dosis de tratamiento y si la proteinuria en orina es mayor a 2 g/24 horas, la interrupción del mismo.
TOXICIDAD NEUROLÓGICA
La frecuencia de las complicaciones neurológicas en los pacientes con cáncer tratados con quimioterapia ha aumentado considerablemente en los últimos años, debido principalmente a la mayor agresividad e intensidad de los tratamientos y al aumento de la supervivencia de los pacientes, que ha llevado a la aparición de efectos tóxicos tardíos.
La relación temporal entre la administración de la quimioterapia y la aparición del problema neurológico, la exclusión de otras causas posible y el conocimiento de los efectos secundarios específicos de los agentes quimioterápicos permitirán establecerlos como causa de estos trastornos.
No existe actualmente un tratamiento eficaz que prevenga la aparición de neuropatía, y cuando aparece, no hay tratamiento eficaz que la revierta, salvo el cese del tratamiento quimioterápico (aunque en ocasiones queda un daño irreversible, que no mejora con la retirada de la quimioterapia), esto hace que sea imprescindible la correcta valoración neurológica antes del inicio del tratamiento, para prevenir y tratar aquellas situaciones que pueden agravar este efecto tóxico.
Es muy importante, que los pacientes reconozcan las manifestaciones clínicas que pueden ser señales de alarma de aparición de una neuropatía:
- Ampliación de la base de sustentación al caminar.
- Inestabilidad al caminar (más en oscuridad)
- Dolor al caminar
- Debilidad en parte distal de las extremidades
- Pérdida de fuerza en dedos de manos, dificultad para realizar tareas que requieran precisión
- Debilidad al flexionar tobillos.
- Pérdida de audición
- Pérdida de sensibilidad (también pérdida de sensación térmica)
- Alteraciones sensitivas (percepción dolorosa)
- Desaparición de los reflejos osteotendinosos
- Ruidos intestinales, alteración en la motilidad intestinal
Los efectos neurotóxicos pueden aparecer inmediatamente o diferidos (incluso tras largos periodos desde la finalización del tratamiento) El daño no solo depende del fármaco empleado, sino que también de la duración del tratamiento y la dosis acumulada del fármaco.
El diagnóstico es clínico, y los síntomas o síndromes (asociación e síntomas) que aparecen dependerán de la zona del sistema nervioso dañada, pudiendo dividirse en seis grandes grupos:
1. ENCEFALOPATIA AGUDA
Se inicia durante el tratamiento, y consiste en confusión progresiva asociada a alucinaciones, afasia (alteración en el habla), letargia, somnolencia y ocasionalmente convulsiones y coma. Se resuelve habitualmente entre 10-14 días después de cese del tratamiento, aunque ocasionalmente pueden quedar daños irreversibles.
2. ENCEFALOPATIA CRONICA
Consiste en la instauración progresiva de una demencia. Se inicia entre los 2 meses y los dos años del tratamiento, puede progresar hasta el coma y la muerte del paciente.
3. TOXICIDAD CEREBELOSA
Aparecen síntomas de daño cerebeloso: ataxia, dismetría, disartria, nistagmo. Su inicio suele ser agudo (durante el tratamiento) y pueden quedar daños irreversibles.
4. PARALISIS DE LOS NERVIOS CRANEALES
Aparición de parálisis facial, o movimientos oculares rápidos. Se inician durante el tratamiento siendo su curso variable.
5. MIELOPATIA
La aparición de incontinencia urinaria o fecal y alteraciones sensitivas o motoras (alteraciones en la movilidad de extremidades) a un determinado nivel, nos harán pensar en daño medular. Su inicio puede ser a las horas o días del tratamiento, siendo su curso progresivo.
6. NEUROPATIA PERIFERICA
Se trata del daño neurológico más frecuente, aparece por alteraciones en las fibras de conducción nerviosa, lo que lleva a la pérdida de sensibilidad (posicional, vibratoria, dolorosa y/o térmica) generalmente en las extremidades (característicamente distribución en guante y calcetín). Los pacientes lo describen como presencia de hormigueos (parestesias) en dedos de manos y pies, que conforme progresan se tornan dolorosas (disestesias).
Aparecen a las semanas del tratamiento, suelen ser dosis dependientes y presentan una mejoría lenta y progresiva tras el cese de la quimioterapia (generalmente persiste cierto nivel de daño irreversible).
En cada visita se pregunta a los pacientes por la aparición de síntomas de daño neurológico, proponiendo reducción de dosis de quimioterapia o suspensión del tratamiento cuando el daño produce algún grado de incapacidad para realizar ciertas actividades de la vida diaria.
El Oxaliplatino, provoca de manera característica una toxicidad aguda muy frecuente (85-95% de los pacientes) en forma de alteraciones sensitivas en zona perioral (boca) y distal (extremidades). En un pequeño porcentaje de pacientes (2%), durante la administración del primer ciclo de quimioterapia aparecen alteraciones sensitivas faringolaríngeas intensas, produciendo dificultad para tragar o respirar. Es importante informar al paciente que no se trata de una obstrucción de la vía aérea, ceden espontáneamente en las horas siguientes, se repiten en los siguientes ciclos y se agravan con la ingesta de bebidas o alimentos fríos.
Tratamiento
Tratamiento farmacológico:
En ocasiones se realiza la suspensión o reducción de la dosis del quimioterápico neurotóxico, al alcanzar una dosis acumulada, para disminuir el riesgo de neurotoxicidad; o cuando aparece cierto grado de toxicidad, reanudando el tratamiento cuando desaparecen los síntomas.
El objetivo es el control de los síntomas, para ello es preciso en ocasiones asociar varios fármacos:
- Analgésicos: Se trata de un dolor de difícil control, denominado dolor neuropático, que precisa de la asociación de antiinflamatorios, opiáceos, antidepresivos y/o anticonvulsionantes.
- Antidepresivos: Amitriptilina (Tryptizol®)
- Anticonvulsionantes: Gabapentina(Neurontín®) o Pregabalina (Lyrica®)
- Neuroprotectores: Aunque no hay datos concluyentes, se valora la eficacia de agentes como la amifostina, glutamina, infusiones de calcio y magnesio con la quimioterapia, con el objetivo de minimizar el daño neurológico.
Consejos para los pacientes:
- Proteger manos y pies de temperaturas extremas (guantes y calcetines).
- Controlar la temperatura del agua para evitar quemaduras,
- No usar agua muy caliente o fría para ducharse o lavarse las manos, o lavar platos.
- Utilizar ropa ancha y calzado cómodo
7. LEUCOENCEFALOPATIA POSTERIOR REVERSIBLE (RPLS)
Trastorno neurológico que se puede manifestar clínicamente: cefalea, letargia, confusión, convulsiones, ceguera, HTA aguda y otros trastornos neurológicos consecuencia de edematización de la sustancia blanca posterior. Frecuentemente se asocia a hipertensión moderada o severa pero no es preciso para el diagnóstico, el cual se hará mediante técnica de imagen con IRM.
Tratamiento
Ante la aparición de RPLS, se debe interrumpir el tratamiento con el inhibidor de la angiogénesis, e iniciar el tratamiento antihipertensivo.
Los síntomas suelen mejorar y resolverse en unos días, aunque enalgunos pacientes pueden quedar secuelas neurológicas.
HIPERTENSIÓN ARTERIAL
Es un efecto de clase de todos los inhibidores de la angiogénesis, tanto de los anticuerpos monoclonales como de los inhibidores de la Tirosin-Kinasa.
La hipertensión grado 3-4 (según el criterio de toxicidad de la NCICTC), producida por Bevazucimab, se estima, en un 8-18 %, siendo la incidencia de hipertensión grado 4 secundaria a Bevacizumab menor al 1 %.
Consideramos:
- Hipertensión grado 3: aquella en que requiere de más de un fármaco antihipertensivo o tratamiento más intensificado que el que llevaba el paciente previamente, para la adecuada regulación de ésta.
- Hipertensión grado 4: se define como aquellas situaciones amenazantes para la vida como la crisis hipertensiva.
Tratamiento
El tratamiento de la hipertensión secundaria al uso de agentes antiangiogénicos, y teniendo en cuenta el mecanismo fisiopatológico de actuación de los mismos, la vasoconstricción, consiste fundamentalmente en drogas vasodilatadoras.
Se consideran fármacos de elección: los IECAs, ARA-II o los antagonistas del Calcio.
En el caso de que con la utilización de dos fármacos antihipertensivos a dosis máximas no sea suficiente para la normalización de cifras, o que la hipertensión se acompañe de signos y/o síntomas de daño orgánico, el tratamiento con inhibidores de angiogénesis deberá ser interrumpido.
TOXICIDAD CARDIACA
Definimos cardiotoxicidad como el daño producido sobre el músculo cardíaco por los fármacos antineoplásicos utilizados en el tratamiento contra el cáncer. La forma de presentarse es generalmente como una miocardiopatía que evoluciona a una insuficiencia cardiaca, o como alteraciones en la contractilidad cardiaca que se manifiestan como arritmias.
1. MIOCARDIOPATÍAS QUIMIOINDUCIDAS:
Las antraciclinas son el ejemplo más claro de esta toxicidad. Producen un daño miocárdico que es dosis dependiente, lo que lleva a un fallo cardiaco (insuficiencia cardiaca congestiva, ICC) con el incremento de dosis. Aparece insuficiencia cardiaca en el 7,5% de los pacientes que han recibido una dosis acumulada de doxorrubicina de 550 mg/m2, y dicho porcentaje aumenta de forma lineal a partir de dicha dosis
Hay tres formas de presentación de la toxicidad cardiaca asociada a antraciclinas:
- Cardiotoxicidad aguda. Ésta ocurre durante el tratamiento o pocas horas después de su administración y consiste principalmente en taquicardias. Estos efectos son, por lo general, transitorios y ocurren en hasta un 40% de los pacientes; no son dependientes de la dosis ni están relacionados con el desarrollo de miocardiopatía posterior. En algunos casos pueden evolucionar desarrollando un derrame pericárdico, pudiendo llegar al fallo cardiaco. Desaparecen al interrumpir el tratamiento.
- Cardiotoxicidad crónica. Puede aparecer después de la administración de la última dosis hasta 30 meses más tarde, con un pico a los 3 meses de su última administración. Es debida al desarrollo de una miocardiopatía degenerativa dependiente de la dosis y que puede culminar en un fallo cardíaco congestivo (ICC). Las manifestaciones clínicas son indistinguibles de otras formas de fallo cardíaco:
|
- Taquicardia sinusal (aumento del número de pulsaciones cardiacas)
- Taquipnea (aumento del número de respiraciones)
- Disnea (sensación de falta de aire o fatiga)
- Cardiomegalia
- Edema periférico (hinchazón de extremidades)
- Edema pulmonar (acumulo de líquido en pulmones)
- Hepatomegalia
- Congestión venosa
- Derrame pleural (presencia de líquido en pleura)
- Signos de bajo gasto (hipotensión, frialdad de extremidades, mareos)
|
3. Cardiotoxicidad tardía. descompensaciones tardías de enfermos que se han recuperado de una cardiotoxicidad subaguda o fallos cardíacos de novo, pueden aparecer 6 a 20 años después del tratamiento. Pueden aparecer arritmias graves, incluyendo taquicardias y fibrilaciones ventriculares y bloqueos de segundo y tercer grados. El estado cardíaco, medido con métodos no invasivos (ECOcardiografía) al término del tratamiento con antraciclinas predice la probabilidad de desarrollar alteraciones tardías orientándonos así sobre la frecuencia de seguimiento a largo plazo.
Tratamiento
El mejor tratamiento, es una vez más la prevención. Es muy importante detectar precozmente aquellos pacientes con riesgo de toxicidad. Es imprescindible comunicar al oncólogo la existencia de cualquier grado de disfunción cardiaca, así como la toma de medicación como diuréticos o antiarrítmicos.
La realización de una ecocardiografía previa al tratamiento y al finalizarlo detecta alteraciones en la contractilidad cardiaca y en su función. El principal método de prevención es limitar la dosis total acumulada de los fármacos.
El tratamiento farmacológico es el de cualquier insuficiencia cardiaca, con el empleo de fármacos como IECAS (inhibidores de la enzima conversiva de la angiotensina: enalapril, captopril) , betabloqueantes (carvedilol, metoprolol, bisoprolol) y diuréticos (furosemida, clortalidona, torasemida) e incluso trasplante cardíaco en enfermos refractarios al tratamiento y libres de enfermedad neoplásica.
2. ARRITMIAS CARDIACAS Y PROCESOS ISQUEMICOS:
Pueden aparecer cuadros de fibrilación auricular, bradicardias y cambios electrocardiográficos.
En ocasiones, pueden aparecer cambios en el electrocardiograma hasta en el 60% de los pacientes, aunque de manera característica produce vasoespasmo de los casos coronarios, con aparición de dolor torácico, taquicardia, disfunción cardiaca y de forma excepcional infarto de miocardio y fallo cardiaco. Aparece en las primeras doce horas del fin del ciclo de quimioterapia, siendo más frecuente en el segundo ciclo. Desaparece espontáneamente y responde a tratamiento farmacológico (nitritos y antagonistas del calcio).
3. ENFERMEDAD TROMBOEMBÓLICA
La enfermedad tromboembólica venosa es una de las complicaciones más frecuentes en el paciente con cáncer, y puede tener graves consecuencias como la trombosis venosa profunda y/o la embolia pulmonar.
Para reducir su incidencia es necesario identificar los pacientes con mayor riesgo de desarrollar una trombosis venosa, por lo que debe informar a su oncólogo de la existencia previa de trombosis en extremidades, así como de los medicamentos que toma habitualmente, y del tipo de actividad física que realiza diariamente (mayor riesgo en pacientes con nula o mínima actividad diaria) para valorar la posibilidad de instaurar tratamiento preventivo con Heparinas de bajo peso molecular (Hibor®, Clexane®, Fagmin®).
Existe un alta incidencia de accidentes isquémicos transitorios (AIT), accidentes cerebrovasculares (ACV), angina de pecho e infartos de miocardio en pacientes en tratamiento con inhibidores de la angiogénesis, a menudo asociado a hipertensión y daño microvascular largamente mantenido en el tiempo.
Los factores de riesgo más importantes asociados al desarrollo de estos eventos son: la edad superior a 65 años, presentar una historia previa de este tipo de patología y desde el punto de vista fisiopatológico parece ser que el daño endotelial es básico.
Los catéteres venosos centrales (reservorios) se utilizan frecuentemente en los pacientes con cáncer para la administración de quimioterapia, nutrición parenteral, preparados hematológicos o la extracción de sangre. Su presencia se asocia con mayor riesgo de trombosis venosas, infecciones o flebitis. Los estudios recientes han demostrado que la prevención primaria con Heparinas de bajo peso molecular solo se debe instaurar en los pacientes con otros factores de riesgo asociados.
En cuanto a las infecciones, podemos encontrar tres tipos: las del orificio de salida, la bacteriemia o sepsis y la infección del túnel. Las del orificio de salida están causadas por gérmenes de la piel y se tratan con antisépticos o antibióticos tópicos. La infección del catéter esta mediada por gérmenes más agresivos como el S. Aureus o P. Aeruginosa, y para su tratamiento será necesario la retirada del catéter y en ocasiones el desbridamiento quirúrgico. En cuanto a la bacteriemia (gérmenes presentes en sangre), será preciso administrar antibióticos a través del catéter y, si no hay mejoría retirada del mismo.
TOXICIDAD PULMONAR
La quimioterapia puede también producir daño a nivel pulmonar, sobretodo si se administra conjuntamente con radioterapia sobre la región torácica. La toxicidad puede ser aguda, cuando aparece en el curso del tratamiento, o tardía, en relación con aparición de fibrosis pulmonar a los años de haber finalizado la quimioterapia.
1. TOXICIDAD AGUDA:
Las manifestaciones más frecuentes son la aparición de tos, disnea (sensación de falta de aire) y febrícula que aparecen inmediatamente a la administración de quimioterapia hasta meses después de haber finalizado.
Este cuadro se engloba dentro de las llamadas Pneumonitis intersticiales inflamatorias, presentando alteraciones radiográficas típicas (infiltrados pulmonares algodonosos). Se caracterizan por su buen pronóstico, resolviéndose con la suspensión del tratamiento y en los casos más persistentes con corticoides.
Este cuadro ha cobrado importancia al relacionarse con el tratamiento con inhibidores de la Tirosin-Kinasa, tanto Gefitinibcomo Erlotinib. En este caso, aparece típicamente dentro de los primeros 90 días de tratamiento, como una neumonía Intersticial de aparición aguda, siendo fatal en un tercio de los casos y cuya frecuencia aumenta en pacientes con antecedente de fibrosis pulmonar, historial de tabaquismo y/o radioterapia torácica previa. El tratamiento consiste en la interrupción del tratamiento y la corticoterapia sistémica. En casos severos, el paciente puede precisar del uso de ventilación mecánica.
El Trastuzumab, puede producir una pneumonitis con rápida progresión de los infiltrados pulmonares y fallo respiratorio tras la primera dosis o tras 6 semanas de tratamiento
2. TOXICIDAD TARDÍA:
Se trata de un proceso denominado Fibrosis Pulmonar, que se caracteriza por la sustitución progresiva de los alveolos (unidad funcionante de los pulmones) por tejido fribrótico, de forma que se impide poco a poco la capacidad del pulmón de intercambiar oxígeno con el torrente circulatorio.
Los síntomas característicos son:
|
- Dificultad respiratoria (falta de aire) especialmente al hacer ejercicio.
- Tos seca y crónica.
- Debilidad y fatiga.
- Molestias en el pecho.
- Perdida del apetito.
- Rápida pérdida de peso.
|
El tratamiento, pasa por una correcta prevención. En las fases agudas los corticoides son eficaces, siendo necesaria una supresión paulatina para evitar los rebrotes. En los casos con fibrosis pulmonar severa instaurada, el único tratamiento eficaz es el trasplante pulmonar, en los pacientes con neoplasias curadas.
DISFUNCIONES SEXUALES
La disfunción gonadal y la alteración de la actividad sexual también pueden ser debidas a los tratamientos quimioterápicos. Las causas más comunes de disfunción sexual tienen frecuentemente origen físico y psicológico. Los problemas que aparecen más frecuentemente son la pérdida del deseo sexual en hombre y mujeres, en los hombres pueden aparecer problemas para alcanzar y mantener una erección, incapacidad para eyacular o, eyaculación retrógrada o imposibilidad de alcanzar un orgasmo; en las mujeres aparece frecuentemente dolor durante el coito, cambios en la sensibilidad genital por dolor, falta de sensibilidad, capacidad disminuida para llegar al orgasmo.
Supone un problema muy importante en la población de adultos jóvenes con cáncer, que ven disminuida su fertilidad como consecuencia de los tratamientos recibidos. Los problemas sexuales, en ocasiones no se solucionan una vez han finalizado los tratamientos, por lo que interfieren de una forma muy importante en la vuelta a una vida normal y por lo tanto en la calidad de vida.
1. DISFUNCION GONADAL EN MUJERES:
- Amenorrea transitoria: consiste en la ausencia de menstruación durante un periodo igual o superior a 6 meses; siendo su duración variable (meses-años).
Esta alteración en la función ovárica está relacionada con múltiples factores además del tratamiento quimioterápico: estrés, malnutrición, pérdida de peso. Es independiente de la edad.
- Amenorrea permanente o menopausia: ausencia de menstruación durante un periodo de tiempo superior a 12 meses de manera irreversible. Su incidencia aumenta con la edad de la paciente en el momento del tratamiento; y puede ir precedida de una oligomenorrea (ciclos menstruales entre 40 días y 6 meses de duración).
2. DISFUNCION GONADAL EN VARONES:
Los quimioterápicos producen una disminución de las células madre germinales, lo que hace que los espermatozoides detengan su maduración, pudiendo presentar alteraciones en su material genético. Estas alteraciones genéticas y las alteraciones funcionales pueden ser evidentes desde las primeras semanas, mientras que la oligospermia (disminución del número de espermatozoides) no se detecta hasta los 3 meses. Posteriormente aparece atrofia y disminución del tamaño testicular y secundariamente una disminución de la testosterona.
La recuperación de la función gonadal suele ocurrir en los tres primeros años del fin del tratamiento, aunque en algunos casos suele ser más prolongada e incluso permanente.
3. DISFUNCION SEXUAL
Se trata de un problema infravalorado por los oncólogos, siendo su origen multifactorial: alteraciones hormonales inducidas por los tratamientos, trastornos psicológicos (reacciones de ansiedad y depresión adaptativas a la enfermedad y su tratamiento, pérdida de autoestima), trastornos funcionales relacionados con el deterioro físico.
En los varones el problema principal es debido a la disfunción eréctil, secundaria generalmente a los tratamientos quirúrgicos o radioterápicos. Los agentes quimioterápicos ocasionan disfunción sexual secundaria a la aparición de una disfunción gonadal, siendo las manifestaciones principales la reducción de la libido y de la capacidad de alcanzar el orgasmo, la disfunción eréctil, la alteración de la eyaculación y la disminución de la actividad sexual. Todas ellas relacionadas con la disminución de la testosterona.
Los tratamientos farmacológicos (Viagra®), pueden mejorar la disfunción eréctil, aunque su efectividad es limitada.
En la mujer, los tratamientos quirúrgicos o radioterápicos sobre la zona genital, conllevan disfunciones sexuales importantes y persistentes. Los síntomas más frecuentes son la disminución o ausencia de deseo sexual, sequedad vaginal, dispareunia (dolor vaginal durante la relación sexual), estenosis vaginales. En un porcentaje importante de pacientes diagnosticadas de cáncer de mama, se desarrollan disfunciones sexuales, siendo los factores psicológicos el origen de la mayoría de ellas (reducción del deseo sexual, frigidez). El apoyo psicológico y de las parejas supone la ayuda más importante en la adaptación de las mujeres.
Consejos para los pacientes:
- Solicite información sobre las posibilidades de infertilidad secundarias a los tratamientos.
- Solicite información sobre los efectos físicos y psicológicos que pueden aparecer sobre el deseo sexual, la función eréctil.
- Emplee durante le tratamiento métodos anticonceptivos eficaces, por el riesgo asociado de alteraciones genéticas y teratogénicas.
- Los varones que deseen descendencia deben solicitar información sobre la criopreservación de semen previo al tratamiento quimioterápico. La criopreservación de tejido ovárico es una técnica experimental.
ALTERACIONES EN LOS ÓRGANOS DE LOS SENTIDOS
1. CONJUNTIVITIS
Aparece por acción directa sobre la conjuntiva ocular, aunque también se ve favorecida por la caída de las pestañas. Cuando se cronifican pueden producir la estenosis (obstrucción) del conducto lacrimal. Se tratan con colirios con corticoides y antiinflamatorios.
2. PERDIDA DE VISION
Alteraciones de la agudeza visual, cambios en la percepción de los colores, son las alteraciones que aparecen más frecuentemente.
3. ALTERACIONES AUDITIVAS
Aparece inicialmente pérdida de audición en las frecuencias altas, como ya se ha comentado está relacionada con la neurotoxicidad. Es una toxicidad dosis acumulada.
4. ALTERACIONES DE GUSTO Y OLFATO
Se desconocen los mecanismos de producción, siendo trastornos muy frecuentes, relacionados probablemente con la toxicidad sobre las mucosas como por daño nervioso.
TOXICIDAD HEMATOLÓGICA
Los quimioterápicos no actúan exclusivamente sobre la célula tumoral, al actuar sobre los distintos mecanismos de la división celular, afectan también a las células sanas, especialmente a las que tiene una gran capacidad de replicación o renovación. Las células ematopoyéticas (células progenitoras de las células sanguíneas) localizadas en la médula ósea, son las más expuestas a esta destrucción, efecto que se conoce como mielosupresión. La mayoría de quimioterápicos empleados producen la disminución de las células sanguíneas, al actuar sobre la maduración y proliferación de sus células precursoras.
El tiempo y duración de la mielosupresión depende no sólo del esquema quimioterápico (fármacos, dosis, duración, vía de administración) sino que también del paciente (edad, estado nutricional, funcionamiento de la médula, tratamientos previos.
Para conocer los efectos que los quimioterápicos ejercen sobre las células sanguíneas es preciso saber que existen tres tipos de células sanguíneas:
− Los glóbulos rojos o hematíes, encargados de transportar el óxigeno a todas las células del cuerpo, haciéndolo a través de la hemoglobina que contienen.
− Los glóbulos blancos o leucocitos, defienden al cuerpo de las infecciones. Existen distintos tipos de leucocitos, que ejercen diferentes funciones:
1. Los neutrófilos o segmentados, protegen contra la mayoría de las infecciones.
2. Los linfocitos B, producen los anticuerpos que localizan los gérmenes, se adhieren a ellos, destruyen los gérmenes específicos y señalan a otros para destruirlos.
3. Los linfocitos T, atacan directamente a los gérmenes, también liberan citocinas que activan a otras células para participar en la respuesta defensiva.
4. Las plaquetas, detienen el sangrado, al formar coágulos que sellan las perforaciones de los vasos sanguíneos ocurridas en cortes o magulladuras.
Los toxicidad sobre las células hematopoyéticas se presenta de distinta forma clínica y significado en función de las células sanguíneas que disminuyan, así tendremos: anemia (disminución de la cifra de glóbulos rojos o hematíes), leucopenia (disminución de la cifra de glóbulos blancos o leucocitos), neutropenia (disminución de la cifra de neutrófilos, un tipo especial de leucocitos), trombopenia o plaquetopenia (disminución de la cifra de plaquetas), aplasia medular (cuando diminuyen todas las células sanguíneas). Aparece entre la primera y la tercera semana tras el tratamiento, y en función de su severidad, puede afectar de manera importante la calidad de vida de los pacientes, precisando en ocasiones retrasar los tratamientos o incluso modificarlos.
En general, los fármacos antidiana, producen poca toxicidad hematológica.
Grados de toxicidad hematológica NCI
|
|
Grado 1
|
Grado 2
|
Grado 3
|
Grado 4
|
|
Hemoglobina
(Anemia)
|
Normal- 10 g/dl
|
10-8 g/dl
|
8-6.5 g/dl
|
< 6.5 g/dl
|
|
Leucocitos
(Leucopenia)
|
Normal-3000/mm3
|
3000-2000/mm3
|
2000-1000/mm3
|
< 1000/mm3
|
|
Neutrófilos
(Neutropenia)
|
Normal-1500/mm3
|
1500-1000/mm3
|
1000-500/mm3
|
< 500/mm3
|
|
Plaquetas
(Trombopenia)
|
Normal-75000/mm3
|
75000-50000/mm3
|
50000-25000/mm3
|
< 25000/mm3
|
1. ANEMIA
Se define como una disminución de los niveles de hemoglobina (Hb) por debajo de 12 g/dl. Aproximadamente un 75% de los pacientes con cáncer en tratamiento quimio o radioterápico presentan anemia moderada, con cifras de hemoglobina entre 12 y 8 g/dl.
La incidencia de anemia en el paciente en tratamiento quimioterápico va a depender de diversos factores tales como el tipo y dosis de quimioterápico utilizado o el tipo de tumor (más frecuente en linfomas, pulmón, ovario, genitourinario), produciendo sintomatología diversa (astenia, taquicardia, disnea...) según grado de severidad y la velocidad de instauración. No solo influye en la calidad de vida del paciente sino que también en la efectividad del tratamiento oncológico. La anemia puede ser un factor pronóstico independiente en la supervivencia del paciente oncológico.
La astenia (ver astenia) relacionada con la anemia afecta de forma negativa a la calidad de vida de los pacientes.
Tratamiento
En el tratamiento de la anemia del paciente con cáncer, dependiendo del grado de severidad y de las circunstancias clínicas, se utiliza la transfusión de concentrados de hematíes y la eritropoyetina (EPO).Las trasfusiones son muy efectivas, al controlar los síntomas de una forma rápida y eficaz, pero los riesgos asociados a su empleo (infecciones víricas o reacciones inmunes), y la corta duración de su efecto hace que no sea el tratamiento de elección.
La EPO es una hormona sintetizada en el hígado (90%) y en el riñón (10%) y cuya principal función es la estimulación de células progenitoras. En el paciente con cáncer existe una producción de EPO endógena insuficiente. Su utilización exógena permite disminuir el número de transfusiones. Antes de utilizar EPO es necesario descartar la existencia de otras causas de anemia como la existencia de sangrado, hemólisis y deficiencias de hierro, ácido fólico o vitamina B12.
Habitualmente se recomienda su utilización en pacientes con Hb <10 g/dl y se puede seguir el siguiente esquema:
- Iniciar con una dosis de EPO
- Si a las cuatro semanas de tratamiento no existe respuesta se incrementa la dosis
- La respuesta al tratamiento se mide por el incremento de la hemoglobina.
- Tanto antes del tratamiento con EPO como durante el mismo se debe descartar la existencia de déficit de hierro (ferrritina sérica <100 ng/ml o saturación <20%). Si existe déficit es necesario corregirlo mediante la administración de hierro oral o parenteral.
La administración de Eritropoyetina puede producir efectos adversos como hipertensión, trombosis, cefalea.
2. NEUTROPENIA
La neutropenia se define como la reducción de la cifra de neutrófilos en sangre periférica, por debajo de 2000 cels/mm3 (se define la neutropenia severa cuando el recuento es menor de 500 neutrófilos/mm³).
Este descenso del número de neutrófilos en sangre periférica conlleva una importante alteración de los mecanismos de defensa del paciente. La principal complicación que se puede producir en el paciente neutropénico es la infección, que puede llegar a ser mortal. El riesgo de infección aumenta con el grado y la duración de la neutropenia. Siendo el riesgo máximo con cifras de neutrófilos menores de 100/mm3.
Se denomina neutropenia febril a la existencia de temperatura axilar mayor de 38,5º C durante más de una hora y con un recuento absoluto de neutrófilos menor de 500 mm³. En un 48-60% de los pacientes que presentan neutropenia febril existe una infección. Se trata de una situación amenazante para la vida del paciente, por el alto riesgo de infecciones agresivas y la deficiente respuesta defensiva que puede desarrollar el paciente.
Los principales factores de riesgo para el desarrollo de infección cuando el recuento de neutrófilos es bajo (neutropenia febril) son:
- El tipo de cáncer (más frecuente en los tumores hematológicos).
- Tipo e intensidad de la quimioterapia.
- Edad ≥60 años.
- Enfermedades concomitantes.
- Sexo femenino.
- Mal estado nutricional.
- Pacientes hospitalizados.
- Cáncer no controlado o en progresión.
- Neutrófilos < 100/mm3.
- Neumonía asociada u otras infecciones graves.
- Transplante de células madre reciente.
- Alteración hepática o renal.
- Deshidratación y/o hipotensión.
- Enfermedad pulmonar obstructiva crónica.
SÍNTOMAS DE ALARMA, que pueden indicar infección cuando hay un descenso de los neutrófilos:
- Fiebre.
- Cansancio.
- Dolor de cabeza.
- Dolores musculares.
- Sensación de calor o frío.
- Escalofríos o tiritona.
- Dolor de garganta.
- Tos o dificultad para respirar.
- Congestión nasal.
- Escozor al orinar.
- Enrojecimiento, hinchazón o dolor en lesiones o heridas quirúrgicas o catéteres.
- Dificultad para tragar.
- Dolor en abdomen.
- Diarrea.
- Molestias en recto o ano al defecar.
Para prevenir la incidencia y disminuir la duración de la neutropenia post-quimioterapia se utilizan factores estimulantes de colonias de granulocitos (G-CSF), que están indicados en los siguientes casos:
- Profilaxis Primaria en pacientes con alto riesgo de desarrollar neutropenia febril o en aquellos que en caso de desarrollarla tienen riesgo de presentar complicaciones severas (edad avanzada, tratamiento previos, mal estado general).
- La Profilaxis secundarios a se realiza en pacientes que desarrollaron neutropenia febril en ciclos previos.
- En la neutropenia febril se usan junto con el tratamiento antibiótico en pacientes en los que se prevea una alto riesgo de complicaciones asociadas a la infección y tengan factores de mal pronóstico (<110 neutrófilos/ mm³, enfermedad primaria no controlada,
hipotensión, bacteriemia, comorbilidad).
Los factores estimulantes de granulocitos (G-CSF) se utilizan a dosis de 5 m/ Kg/ día por vía subcutánea, 24-72 horas después de finalizar el ciclo de quimioterapia. Se suele mantener el tratamiento hasta que se alcanza un recuento de neutrófilos de 10.000/ mm³.
Consejos para pacientes con neutropenia:
- Evitar el contacto con personas con infecciones activas o refriados, hasta que la cifra de neutrófilos se recupere
- Lavar la boca y cepillar los dientes con suavidad 3 o 4 veces al día
- Mantener limpia la piel (usar jabones neutros)
- Lavar las manos antes de las comidas y tras ir al baño
- Evitar el contacto con heces de animales
- Acudir a urgencias si presenta fiebre de 38ºC o escalofríos o tiritonas o síntomas de infección de algún órgano.
3. TROMBOPENIA:
Se entiende por trombopenia la disminución del recuento sanguíneo de plaquetas (<100.000-150.000/l). Su principal complicación clínica es la hemorragia que puede llegar a ser mortal, aunque normalmente no se producen complicaciones hemorrágicas importantes con recuentos superiores a 20.000/l .
Las hemorragias pueden aparecer en distintas localizaciones: epistaxis (nasal), hemoptisis (pulmonar, con la tos), hematemesis (gastrointestinal), melenas (en heces, gastrointestinal). Otra manifestación puede ser la aparición de hematomas (moraduras o cardenales) o petequias (pequeñas manchitas rojas del tamaño de una cabeza de alfiler, que aparecen en extremidades.
Cuando existe trombopenia y dependiendo de su grado de severidad puede ser necesaria la transfusión profiláctica de plaquetas.
Consejos para pacientes con trombopenia:
- Evitar el riesgo de traumatismos o heridas.
- Precaución con las maquinillas de afeitar.
- Evitar el estreñimiento.
- Aumentar la ingesta de líquidos para una correcta hidratación.
- Emplear cepillas de dientes suaves.
- Evitar el empleo de enemas, supositorios y laxantes potentes.
- Emplear protectores gástricos (sobretodo si tiene prescritos antiinflamatorios).
- Evitar los antiagregantes plaquetarios como la Aspirina, sustituyéndolos por Paracetamol.
En caso de hemorragia nasal, presionar con los dedos en la punta de la nariz y permanecer con la cabeza hacia arriba, hasta que ceda, si persiste acudir a urgencias.
HEMORRAGIAS
Los antiangiogénicos actúan sobre el VEGF (Factor de crecimiento del endotelio vascular) que tiene un papel fundamental en mantener la integridad de los tejidos y la reparación de las heridas, de modo que su inhibición puede interferir en estos procesos fisiológicos, facilitando un retraso en la cicatrización y favoreciendo complicaciones hemorrágicas, así como permitiendo que la integridad tisular se vea amenazada (mucositis).
Debido al retraso producido por Bevacizumab en el proceso de cicatrización de las heridas, no debe usarse dentro de los siguientes 28 días de realización de cirugía mayor.
El tratamiento con Bevacizumab aumenta el riesgo de hemorragia, habitualmente se trata de episodios de hemorragia menor (grado 1) como epistaxis, que aparecen en un tercio de los pacientes tratados. Sin embargo, en determinados pacientes puede aparecer hemoptisis masiva.
Por ello, Bevacizumab no debe administrarse nunca en pacientes con historia reciente de hemoptisis de más de media cucharada de sangre roja.
Otros eventos hemorrágicos menos frecuentes son: hemorragia gastrointestinal, subaracnoidea e ictus hemorrágico.
Evidentemente, en el manejo de estas hemorragias severas, una vez resuelto el proceso agudo, es obligatoria la interrupción del tratamiento.
TRASTORNOS COGNITIVOS
Se caracterizan de forma general por cambios en la conducta asociados a estado de confusión mental. Son los síndromes psiquiátricos que aparecen con mayor frecuencia en los pacientes con cáncer, especialmente en aquellos con enfermedades en fases avanzadas: la tasa de incidencia oscila entre un 30 y un 45%, siendo mayor en las últimas fases de la enfermedad.
Las alteraciones psicopatológicas que aparecen son muy variadas, apareciendo desde trastornos cognitivos (demencia, déficit de memoria o incluso deliro) hasta alteraciones del estado de ánimo, ansiedad, trastornos del sueño, alteraciones del sentido de la realidad (psicosis, alucinaciones).
Se trata de una disfunción cerebral general que asocia trastornos del conocimiento, la atención y la capacidad cognitiva, presentando también alteraciones del comportamiento. Se trata de un trastorno metal orgánico agudo. Los síntomas de que lo definen son:
- Disminución de la concentración.
- Pérdida de la memoria: distorsiones de los recuerdos, respuestas confabulatorias y delirantes.
- Trastornos de la percepción.
- Desorientación temporal e incluso espacial.
- Trastornos de la emoción
- Estos trastornos aparecen de forma aguda, en paciente sin demencia previa.
- Inicio agudo (horas o días) y variabilidad a lo largo del día
- Existencia de una causa subyacente: trastornos médicos, medicación…
- Alteración del ritmo sueño-vigilia (empeoramiento vespertino)
- Labilidad emocional.
Para el diagnóstico es necesario una anamnesis y exploración física completa, realización de exploraciones complementarais para descartar aquellas causas potencialmente tratables (hemograma, bioquímica, TAC…). Es además imprescindible la realización de test de valoración psicopatológica como: Mini-mental Test, test psicomotores, escalas de síntomas.
La existencia cada vez mayor de largos supervivientes, ha hecho que cada vez se de mayor importancia al efecto perjudicial sobre la función cognitiva de los tratamientos quimioterápicos. Estos efectos son más evidentes en aquellos pacientes que reciben tratamientos adyuvantes, por lo que es necesario detectarlos en las fases iniciales para poder incluir a los pacientes en programas de rehabilitación psicológica.
Los problemas cognitivos pueden ser secundarios a causas reversibles como anemia, alteraciones hidroelectrolíticas, medicación. Cuando la causa es debida a los tratamientos administrados (quimio y/o radioterapia), el daño puede ser irreversible, siendo necesarios terapias específicas.
Consejos para pacientes:
- Use un calendario y organice su tiempo, anotando fechas o actividades importantes
- Anote la información nueva o importante
- Utilice notas recordatorias (post-it)
- Realce ejercicios mentales y de memoria, practique crucigramas, puzzles…
El ejercicio físico puede aumentar la actividad mental: pasee, nade, haga ejercicio al aire libre…
TRASTORNOS DEL SUEÑO
Hasta un 45% de los pacientes con cáncer padecen trastornos del sueño. El insomnio es el trastorno más común en los pacientes con cáncer y suele ser secundario a factores físicos y psicológicos relacionados con el cáncer y sus tratamientos.
Los fármacos empleados en el tratamientos del cáncer pueden ocasionar insomnio, así como aquellos fármacos empleados en el tratamiento sintomático: estimulantes del SNC (metilfenidato), sedantes e hipnóticos (benzodiacepinas), antiepilépticos (fenitoina)…
Para evaluar las alteraciones del sueño es preciso analizar los factores predisponentes, los patrones de sueño, el estado emocional del paciente, el grado de ejercicio y actividad diaria, la dieta, los síntomas acompañantes, los medicamentos concomitantes.
Los principales factores predisponentes son:
- Relacionados con la enfermedad: dolor, fiebre, asfixia, prurito…
- Relacionados con el tratamiento: cirugía (dolor, compresión), quimioterapia
- Relacionados con los fármacos concomitantes: empleo de opioides, sedantes/hipnóticos, esteroides, antidepresivos, vitaminas.
- Trastornos psicológicos
- Depresión
- Ansiedad
- Delirio
Tratamiento:
Tratamiento psicológico:
Mediante las intervenciones psicológicas el paciente aprende a controlar el estrés provocado por la enfermedad, y el sueño puede mejorar. Se realizan ejercicios de relajación y autohipnosis al acostarse, facilitando la calma y el sueño. Mediante intervenciones cognoscitivas del comportamiento se disminuye la tensión asociada al insomnio disminuyendo la ansiedad y fomentando el sueño.
Consejos para pacientes:
- Crear un ambiente que evite las interrupciones del sueño: disminuir el ruido, apagar las luces, regular la temperatura de la habitación, usar ropa holgada y suave.
- Disminuir las interrupciones del sueño (evaucar y orinar antes de acostarse): evitar tomar líquidos antes de dormir, aumentar el consumo de líquidos y de fibra durante el día.
- Consumir una merienda alta en proteína dos horas antes de acostarse.
- Evitar los alimentos pesados, picantes o azucarados de 4 a 6 horas antes de acostarse.
- Evitar el consumo de bebidas alcohólicas o fumar cigarrillos de 4 a 6 horas antes de acostarse.
- Evitar las bebidas con cafeína.
- Hacer ejercicios (y tratar de terminarlos por lo menos dos horas antes de acostarse).
- Mantener el mismo horario para ir a dormir.
Tratamiento farmacológico:
Cuando pese a las recomendaciones anteriores los trastornos del sueño persisten, se recomienda el empleo de fármacos inductores del sueño.
- Benzodiacepinas (Diazepam, Loracepam): agentes seguros y eficaces en la producción de un sueño natural.
- Antidepresivos tricíclicos (Amitriptilina): muy útiles en pacientes con dolor neuropático o falta de apetito
- Antihistamínicos (Hidroxicina)
- Neurolépticos (Haloperidol): muy útiles en le insomnio asociado a delirium.
ALTERACIONES HIDROELECTROLÍTICAS Y DEL METABOLISMO
1. EDEMAS
Aparición de edemas superficiales, generalmente periorbitarios, en hasta el 50% de los pacientes tratados con Imatinib.
2. HIPOTIROIDISMO
Cuadro clínico caracterizado por astenia, cambios tróficos, estreñimiento y letargia, así como alteraciones bioquímicas como la elevación de TSH, secundario al tratamiento con Sunitinib. Se han encontrado niveles anormales de TSH en el 62 % de los pacientes, y un 36 % de hipotiroidismo primario y persistente.
El riesgo de hipotiroidismo aumenta con la duración del tratamiento con Sunitinib; hasta un 90 % de pacientes tratados durante más de 96 semanas desarrollaron hipotiroidismo.
Tratamiento
Por lo que respecta al manejo de esta toxicidad, dada la alta frecuencia de hipotiroidismo y los síntomas inespecíficos acompañantes:
− Todos los pacientes deberían ser monitorizados (TSH y T4) antes del comienzo del tratamiento con Sunitinib y cada 2 o 3 meses, teniendo en cuenta que bajos niveles de TSH en pacientes con leves síntomas de tirotoxicosis puede preceder al establecimiento del hipotiroidismo.
− Cuando la clínica del hipotiroidismo se ha establecido, ha de ser tratado; incluso debe ser considerado su tratamiento en aquellos casos con hipotiroidismo subclínico.
− Debido a que esta patología es fácilmente tratable, no es indicación para interrumpir el tratamiento con Sunitinib, siendo muy recomendable derivar al paciente a la consulta de Endocrinología.
3. HIPOMAGNESEMIA
Efecto secundario frecuente con los anticuerpos frente al receptor Tirosin-Kinasa: aparece en el 22% de los pacientes tratados con Cetuximab y en el 39%b de los tratados con Panitumumab.
Se produce una alteración en la absorción de magnesio a nivel renal.
Hay que sospecharla en pacientes que desarrollan debilidad muscular durante el tratamiento.
Se recomiendan mediciones rutinarias del magnesio sérico en los pacientes que reciben estos fármacos.
4. HIPERGLUCEMIA
El uso de Temsirolimus se asocia con un 89%de elevación de la glucosa sérica.
Es Importante valorar las cifras de glucemia del paciente antes y durante el tratamiento y avisar al mismo de la probable necesidad de modificación de antidiabéticos orales o insulina, si se trata de un diabético conocido.
5. HIPERLIPEMIA
El Temsirolimus se asocia con elevación de las cifras de colesterol y triglicéridos.
Es importante valorar las cifras de colesterol y triglicéridos previo al comienzo del tratamiento y cada 3-4 semanas, durante el mismo.
6. OTRAS
− Hipofosfatemia: Sunitinib, Imatinib, Sorafenib, Dasatinib
− Hiperglucemia: Temsirolimus, Everolimus
INFECCIÓN
Algunos fármacos con marcado carácter inmunosupresor debe de ser tenido a la hora de emplearse, especialmente junto con otros inmunosupresores como los corticoides.
Especial atención y cuidado se ha de tener en pacientes hepatitis B positivos, ya que se han registrado casos de reactivación de virus de hepatitis B, con hepatitis fulminante y fallo hepático, tras el tratamiento con Rituximab, siendo la mediana de tiempo de diagnóstico de hepatitis de 4 meses tras el inicio de Rituximab. Es por ello que los pacientes portadores de VHB (virus hepatitis B) deberían ser seguidos y monitorizados analíticamente durante el tratamiento y varios meses después de finalizarlo. Ante aparición de reactivación de VHB, el tratamiento con Rituximab deberá ser interrumpido inmediatamente e iniciarse la terapia antiviral correspondiente.
En pacientes tratados con Bortezomib, destacar la reactivación de la infección por virus herpes zoster y herpes simple, documentada en un 13 % de los pacientes que recibieron este tratamiento.
TOXICIDAD TARDÍA
En las últimas décadas se ha producido un aumento de la supervivencia global de algunas neoplasias, alcanzando tasas de curación impensables pocos años antes. La existencia de pacientes largos supervivientes, ha permitido conocer la existencia de efectos tóxicos tardíos relacionados con los tratamientos antineoplásicos recibidos, fundamentalmente quimioterapia y radioterapia.
Los principales factores de riesgo de los efectos tardíos son:
- Factores relacionados con el paciente:
- Etapa del desarrollo (edad): mayor frecuencia de aparición en niños y jóvenes.
- Predisposición genética
- Sensibilidad del tejido y capacidad de reparación de tejidos dañados.
- Funcionamiento del resto de órganos no afectados por los tratamientos
- Estado general.
- Factores relacionados con el tratamiento:
- Radioterapia: dosis total, volumen irradiado…
- Quimioterapia: Tipo de fármaco, dosis acumulativa..
- Cirugía
- Factores relacionados con el tumor:
- Efectos que ejerce sobre los tejidos.
- Alteraciones orgánicas que induce.
- Efectos mecánicos.
En la siguiente tabla se enumeran los principales efectos tardíos asociados al tratamiento quimioterápico:
|
Efecto tardío
|
Agentes causantes
|
Signos y síntomas
|
|
Déficit cognitivo
|
Cisplatino, Ifosfamida, 5_FU, Metrotexate, Taxanos, Interferón, Interleukina. RT
|
Alteraciones del comportamiento. Pérdida de memoria, alteraciones de concentración y atención. Demencia
|
|
Pérdida de visión
|
BCNU, Cisplatino. RT
|
Pérdida progresiva de agudeza visual, cataratas
|
|
Alteraciones en las glándulas lacrimales
|
5-Fluoruracilo. RT
|
Disminución de la producción de lágrimas: ojo seco, irritado.
Fibrosis del conducto lacrimal: lagrimeo
|
|
Pérdida de audición
|
Cisplatino, carboplatino. RT
|
Pérdida de audición de frecuencias altas bilateral
|
|
Fibrosis o cirrosis hepática
|
Metrotexate
|
Ictericia, alteraciones de coagulación, varices esofágicas, encefalopatía
|
|
Cardiomiopatía
|
Antraciclinas, dosis altas de ciclofosfamida
|
Fatiga, tos, disnea de esfuerzo, edemas en extremidades
|
|
Fibrosis pulmonar
|
Bleomicina, Busulfan, BCNU, Mitomicina-C, Ciclofosfamida, Ifosfamida.
|
Fatiga, tos, disnea de esfuerzo, mala tolerancia al ejercicio
|
|
Insuficiencia renal
|
Cisplatino, carboplatino
|
Fatiga, anemia, disminución de orina, edemas
|
|
Enteritis
|
Actinomicina D, Doxorrubicina
|
Dolor abdominal, diarrea, pérdida de peso
|
|
Osteonecrosis
|
Esteroides, bifosfonatos
|
Dolor en articulación afectada
|
|
Osteopenia
|
Esteroides, antiestrógenos
|
Fracturas, dolor
|
|
Oligoespermia, azoospermia
|
Ciclofosfamida, CCNU, BCNU, Procarbazina, Busulfan, Ifosfamida
|
Atrofia testicular (más blandos y pequeños), infertilidad
|
|
Insuficiencia ovárica
|
Melfalán, Clorambucilo, Busulfán, Mitomicina, Cisplatino, Etopósido, Procarbacina, Tamoxifeno, Anastrozol, Letrozol, Exemestano, Goserelina, Leuprolina
|
Amenorrea (ausenta de menstruación), acné, sofocos, sequedad vaginal, dispareunia (dolor durante el coito), disminución de la libido, infertilidad
|
SEGUNDAS NEOPLASIAS QUIMIOINDUCIDAS
Los factores que influyen en el desarrollo de segundas neoplasias están relacionados no sólo con el tipo de tratamiento recibido (tanto quicio como radioterápico), sino que se considera que existe una susceptibilidad en el paciente, principalmente debida a mutaciones genéticas.
Las células que se ven más afectadas son aquellas más sensibles a los efectos de la quimioterapia (las de recambio rápido), las células de la médula ósea, células epiteliales del tracto digestivo y los folículos pilosos. Todos agentes quimioterápicos actúan sobre el ciclo de reproducción celular (interrumpiéndolo o deteniéndolo). Esto lleva a la producción de defectos en el material genético, que impiden la replicación y trascripción del ADN, siendo su consecuencia generalmente la muerte celular. Cuando las células, no pueden recuperarse de los efectos que sobre su ciclo reproductor producen los quimioterápicos, mediante los mecanismos de reparación del ADN, pueden aparecer mutaciones, que aumentan el riesgo de desarrollo de segundas neoplasias.
Los quimioterápicos con mayor riesgo de inducir segundas neoplasias son:
1. Alquilantes: Nitrosureas (CCNU, BCNU), clorambucil, ciclofosfamida, melfalan y busulfan.
2. Inhibidores de la topoisomerasa II: Etopósido, irinotecan
3. Antraciclinas: Doxorubicina, epirubicina, daunorubicina, actinomicina D.
En los primeros 10 años, es mayor el riesgo de desarrollar segundas neoplasias hematológicas (leucemias, linfomas), aumentando posteriormente de forma exponencial el riesgo de aparición de tumores sólidos.
Los tumores con mayor frecuencia de segundas neoplasias son:
|
Tumor primario
|
Segunda neoplasia
|
|
Linfoma de Hodgkin
|
Leucemias agudas no linfocíticas, linfoma no Hodgkin, leucemia mieloide, cáncer de vejiga.
|
|
Linfoma No Hodgkin
|
Cáncer de vejiga, leucemia mieloide aguda
|
|
Cáncer de testículo
|
Leucemia mieloide aguda, melanoma, linfoma no hodgkin, tumores sólidos
|
|
Cáncer de ovario
|
Cáncer colorrectal, mama, vejiga, leucemias
|
|
Cáncer de mama
|
Cáncer en mama contralateral, endometrio, leucemias (si trasplante de médula)
|
|
Mieloma
|
Leucemias
|
|
Tumores pediátricos
|
Linfomas, leucemias, cáncer de tiroides, tumores cerebrales
|
Los seguimientos y controles de los pacientes largos supervivientes, permiten evaluar el riesgo de segundas neoplasias y facilita el diagnóstico precoz.
EFECTOS EMOCIONALES
La quimioterapia puede acarrear grandes cambios en su vida. Puede afectar su estado general de salud, amenazar su sensación de bienestar, interrumpir su rutina diaria e imponer una carga en sus relaciones con los demás. Es normal y comprensible que usted sienta tristeza, ansiedad, enojo, y sufra cambios de carácter.
Recomendaciones
Tratar de compartir sus preocupaciones con personas de su entorno y pedir ayuda cuando la necesite puede ser muy importante para vivir esta etapa de la mejor manera.
Además, usted puede obtener apoyo de:
- Personal médico y de enfermería: Si usted tiene preguntas o le preocupa algo acerca de su tratamiento, hable abiertamente con los miembros del equipo médico-enfermera que atiende su caso en el hospital. Igualmente, la relación con su equipo de atención primaria en su centro de salud puede ser de gran ayuda.
- Otros profesionales: Existen profesionales que pueden ayudarle a expresar y/o a entender las emociones que su enfermedad puede causarle. Dependiendo de sus preferencias y necesidades, usted puede hablar con un psiquiatra, un psicólogo, un trabajador social, un terapeuta sexual o un asesor espiritual.
- Grupos de apoyo: Los grupos de apoyo están integrados por personas que están pasando o pasaron por la misma experiencia que usted.
CUÁNDO HAY QUE ACUDIR AL MÉDICO DE FORMA URGENTE
A lo largo del tratamiento con quimioterapia usted se puede encontrar en alguna situación en la que es necesario tomar una decisión: bien esperar a la próxima visita para comunicar a su médico un nuevo síntoma o bien acudir sin demora.
Debe acudir, sin demora, al hospital si entre ciclo y ciclo aprecia:
- Fiebre por encima de los 38º C, sobre todo si se acompaña de tos con expectoración purulenta, fatiga, dolor o hemorragia al orinar, inflamación de la zona del catéter o cualquier otro síntoma asociado con deterioro de su situación general.
- Aparición de hematomas y/o hemorragias sin traumatismo previo o traumatismo mínimo.
- Pérdida de fuerza o sensibilidad en un brazo o pierna de forma súbita
- Pérdida de conocimiento.
- Aparición de fatiga intensa de forma súbita.
- Aparición de taquicardias.
- Vómitos o diarrea importantes y persistentes que no ceden con el tratamiento médico.
Mucositis que le impida ingerir alimentos blandos o incluso líquidos.
TOXICIDAD DE AGENTES BIOLÓGICOS
El concepto agente biológico diana-específico o target, hace referencia a fármacos que actúan directamente sobre proteínas o mecanismos implicados en la proliferación y crecimiento de las células tumorales1. Cuando los nuevos agentes diana-específicos se comparan con la quimioterapia tradicional y se estudia su perfil de seguridad, se objetiva evidencia de menor toxicidad debido a que presentan una mayor selectividad por el tejido patológico que por el tejido sano, este hecho unido a los resultados positivos de respuesta obtenidos en el tratamiento de los distintos tumores, ha propiciado el amplio desarrollo de estos agentes, su inclusión en ensayos clínicos, y su uso, cada vez más frecuente, en la práctica clínica diaria2.
Aún así, a pesar de la alta selectividad de los nuevos agentes biológicos diana-específicos por las células tumorales, su espectro de toxicidad, el rango de gravedad de ésta y los posibles efectos adversos derivados de un uso prolongado de los mismos aún permanece en estudio, y el manejo de éstos va a precisar, en ocasiones, un abordaje multidisciplinar2.
En los últimos años hemos aprendido que la dosis de tratamiento y la duración del mismo es fundamental, para lo cual es necesario un adecuado manejo preventivo y un adecuado tratamiento de los efectos secundarios una vez han aparecido. Considerándose imprescindible para evitar reducciones de dosis y retraso del tratamiento una adecuada educación del paciente, un soporte intensivo durante los primeros 2-3 meses y una prevención y tratamiento adecudado, en el caso de que estos aparezcan.
El objetivo de este capítulo es realizar una breve descripción de las diferentes toxicidades relacionadas con los nuevos agentes diana-específicos, describir los mecanismos patogénicos más frecuentemente implicados para, poder prevenirlas y tratarlas en la medida de lo posible.
TOXICIDAD DE AGENTES ANTI-EGFR
GENERALIDADES
Los agentes diana-específicos frente a los receptores de los factores de crecimiento epidérmico han demostrado ser eficaces en el tratamiento de distintos tumores sólidos.
Se han descrito 4 receptores de factores de crecimiento epidérmico: HER-1 (epidermal growth factor receptor, EGFR o c-erb B1), HER-2 (c-erb B2), HER-3 (c-erb B3) y HER-4 (c-erb B4)2. De los 4 receptores, los dos que presentan mayor implicación terapéutica van a ser EGFR y HER-23.
EGFR se expresa de forma habitual en las células de los distintos tejidos del organismo. Las células normales presentan alrededor de 40.000-100.000 receptores, sin embargo, en muchas células tumorales la expresión de EGFR se encuentra ampliamente aumentada, presentando algunos tumores un porcentaje de sobreexpresión de EGFR cercano al 100%, no siendo el porcentaje de sobreexpresión homogéneo entre los distintos tipos tumorales.
Dado el papel del EGFR en contribuir al desarrollo tumoral y la presencia de sobreexpresión del mismo en numerosos tipos de carcinoma, es una diana clave para tratar tumores que expresen EGFR, bloqueando los mecanismos patogénicos derivados de su activación; para ello, es importante conocer el estatus tumoral de EGFR previo al tratamiento con un inhibidor, con el objetivo de identificar aquellos pacientes que más se van a beneficiar de este tipo de tratamiento.
En la actualidad varios mecanismos de inhibición de EGFR han sido investigados, de todos ellos, los que tienen mayor aplicación clínica son los anticuerpos monoclonales (mAbs) y los inhibidores tirosin-kinasa (TKIs).
Entre los fármacos más importantes inhibidores de EGFR nos encontramos:
- Anticuerpos monoclonales (Cetuximab y Panitumumab)
- Inhibidores Tirosin-kinasa (Erlotinib y Gefitinib)
Tabla 1: Toxicicidad más frecuente de los ac monoclonales anti-EGFR
|
FRECUENCIA
|
EFECTOS ADVERSOS
|
|
> 10%
|
Hipomagnesemia
Aumento de las transaminasas
Reacciones cutáneas
Reacciones infusionales leves o moderadas
|
|
1-10%
|
Deshidratación
Hipocalcemia
Cefalea
Conjuntivitis
Gastrointestinales
Reacciónes graves de infusión
|
|
< 1%
|
Blefaritis, Queratitis
TVP y TEP
|
TOXICIDAD CUTÁNEA
Los efectos adversos más frecuentemente documentados con los IEGFR (tanto anticuerpos monoclonales como los inhibidores tirosin-kinasa) son los derivados de la toxicidad dermatológica. Ocurre en un 50-100% de los pacientes sometidos a tratamiento, siendo dicha toxicidad más florida con Cetuximab y Panitumumab. La forma más común de presentación es la llamada reacción papulopustular o rash acneiforme, que afecta al 60-80% de los pacientes. Es generalmente de leve a moderada y severa únicamente en 5-20% de los mismos. Se define como una erupción dermatológica confinada fundamentalmente a zonas ricas en glándulas sebáceas como son: cara, cuello, zona retroauricular, espalda, parte superior de tórax y cuero cabelludo, pudiendo afectar a otras zonas pero siempre respetando las palmas de las manos y las plantas de los pies4. La erupción es dosis dependiente y tiende a ser más severa, más frecuente y extensa con los anticuerpos monoclonales5 que con los ITK. La cronología de esta toxicidad pasa por distintas fases:
- Alteración sensitiva con eritema y edema (semana 0-1) en las zonas afectas,
- Erupción papulopustular (semanas 1-3)
- Fase de costra (semanas 3-5) y,
- Zona de eritemato-telangiectasia.
Normalmente el rash se resuelve en unas 4-6 semanas desde la aparición, quedando en la zona afecta una evidente sequedad cutánea5.
Otras toxicidades cutáneas4,5 que pueden aparecer en relación al uso de IEGFR incluyen:
- La xerosis o sequedad cutánea: principalmente en pacientes de edad avanzada, que han llevado tratamiento previo con citotóxicos y que presentan historia de eczema atópico. Presenta una frecuencia de aparición en torno al 10%
- Los cambios ungueales: aparecen en el 10-15% de los pacientes y se trata de un evento tardío (raramente aparece antes de las 8 semanas de tratamiento). Se caracterizan porque las uñas tienden a crecer más lentamente, a tener mayor fragilidad y tendencia a romperse. Puede aparecer paroniquia, manifestándose como inflamación del lecho ungueal (habitualmente del primer dedo), dolor y asemejando una uña encarnada.
- Los cambios a nivel piloso se definen por tricomegalia, crecimiento más lento del pelo del cuero cabelludo que se vuelve más fino y rizado, e hipertricosis en la zona facial
- Telangiectasia e Hiperpigmentación: como resultado final de la resolución de la erupción acneiforme. puede agravarse con la exposición solar.
La toxicidad cutánea derivada del uso de IEGFR parece estar relacionada con la respuesta tumoral y la supervivencia del paciente. Por tanto, la aparición del rash y su severidad podría ser un marcador predictivo de la eficacia de los IEGFR.
Manejo de la toxicidad cutánea
No se dispone en la actualidad de recomendaciones de tratamiento basadas en la evidencia para la toxicidad cutánea secundaria a IEGFR, por lo que el manejo de la misma se basa, en la opinión de expertos5,7.
Para el manejo de la toxicidad es preciso realizar, previo al tratamiento, una gradación de severidad de la misma.
TABLA 2. GRADACIÓN DE LA TOXICIDAD CUTÁNEA
|
TOXICIDADES
|
Reacción pustulo-papular
|
síntomas
|
impacto vida diaria
|
sobreinfeccion
|
|
Leve
|
localizada
|
mínimamente
|
no
|
no
|
|
Moderada
|
generalizada
|
prurito o fragilidad cutánea leve
|
mínimo
|
no
|
|
Severa
|
generalizada
|
prurito o fragilidad cutánea severa
|
significativo
|
sobreinfectado o con posibilidad de sibreinfección
|
El objetivo principal del tratamiento de la toxicidad cutánea es aliviar el malestar físico y emocional que sufren los pacientes, en especial aquellos que tienen un peor pronóstico o se encuentran en fases de enfermedad avanzada. Si la toxicidad no se trata adecuadamente, la cumplimentación del tratamiento puede verse comprometida, y en definitiva, sus resultados.
Es imprescindible, antes de iniciar el tratamiento con IEGFR informar a los pacientes de los posibles efectos adversos, medidas preventivas para minimizarlos y tratar las manifestaciones cutáneas cuando sea necesario.
El tratamiento debe de ser individualizado, con una valoración adecuada del tipo y extensión de las lesiones, precisando en los casos más severos de un manejo multidisciplinar con los dermatólogos.
Medidas generales:
- Humedecer las zonas secas de la piel 2 veces al día con un emoliente sin alcohol
- Evitar la exposición solar, con aplicación de protector solar 1-2 horas previas a la exposición
TABLA 3: Medidas de intervención según la gravedad de toxicidad
|
TOXICIDAD
|
TRATAMIENTO
|
MODIFICACIÓN DOSIS IEGFR
|
|
LEVE
|
No requiere intervención
|
No requiere
|
|
MODERADA
|
Hidrocortisona tópica al 1% o al 2.5%
Clindamicina gel al 1%
|
No requiere
|
|
SEVERA
|
Hidrocortisona tópica al 1% o al 2.5%
Clindamicina gel al 1%
|
Reducción dosis
Si no mejora en 2-4 semanas STOP del tratamiento
|
TOXICIDAD GASTROINTESTINAL
La toxicidad gastrointestinal descrita con los IEGFR es consecuencia del daño producido a nivel de la mucosa del intestino delgado y colon, produciendo un exceso de fluidos secretados en la luz intestinal. gastrointestinal y su deficiencia se relaciona con la presencia de sintomatología gastrointestinal.
De este modo, la diarrea es la principal toxicidad limitante de dosis de los TKI de EGFR, y se potencia con la adición de otros fármacos quimioterápicos, como es el caso de la asociación de cetuximab con irinotecan en CCR.
Es importante:
- EDUCAR A PACIENTE: manejo dietético y médico
- Evitar laxantes, fibra y otros factores que contribuyen
- Responde bien a hidratación y antidiarreicos (loperamida)
- Grado 3-4: interrumpir hasta resolución
REACCIONES DE HIPERSENSIBILIDAD
Las reacciones infusionales de hipersensibilidad aparecen de forma frecuente en los tratamientos con mAbs IEGFR, principalmente con el uso de Cetuximab.
Aproximadamente, el 20 % de los pacientes en tratamiento con Cetuximab van a experimentar una reacción de hipersensibilidad de cualquier grado durante la infusión del fármaco. Un 3 % presenta toxicidad grado 3-4, sobre todo, durante la primera dosis de fármaco; por ello, es obligatoria la premedicación con un antihistamínico H1 antes de las administraciones.
HIPOMAGNESEMIA
La aparición de hipomagnesemia, es un efecto secundario frecuente con los mAbs IEGFR, que aparece en el 22 % de los pacientes tratados con Cetuximab10 y en el 39 % de los pacientes tratados con Panitumumab (4 % presentó hipomagnesemia grado 3-4 que precisó tratamiento mediante suplementos orales o intravenosos).
Es importante recordar, en los pacientes que estén en tratamiento con Cetuximab o Panitumumab, realizar una medición rutinaria del magnesio sérico, y sospechar la hipomagnesemia en aquellos pacientes que desarrollen debilidad muscular durante el tratamiento.
TOXICIDAD PULMONAR
Toxicidad descrita principalmente con los TKI de EGFR, tanto Gefitinib como Erlotinib. Frecuentemente se trata de una enfermedad pulmonar intersticial.
Ocurre típicamente dentro de los primeros 90 días de tratamiento, con una incidencia en torno al 1-2 % en las series Japonesas y una mortalidad en torno al 0.87% y una incidencia del 0,3 % en EEUU. La toxicidad es descrita como una neumonía Intersticial de aparición aguda, siendo fatal en un tercio de los casos y cuya frecuencia aumenta en pacientes con antecedente de fibrosis pulmonar, historial de tabaquismo y/o radioterapia torácica previa11.
Por todo ello, la indicación de Gefitinib debería ser cuidadosa, especialmente en pacientes con comorbilidades pulmonares, y en aquellos con sintomatología respiratoria o hallazgos radiológicos de fibrosis durante los 2 primeros meses de inicio de tratamiento con Gefitinib11.
El manejo de la pneumonitis inducida por drogas (tanto de Gefitinib como Erlotinib) consiste en la interrupción del agente causal y la corticoterapia sistémica. Es importante excluir la causa infecciosa de la pneumonitis antes de iniciar el tratamiento corticoideo, por el efecto inmunosupresor que este ocasiona. En casos severos, el paciente puede precisar del uso de ventilación mecánica.
TOXICIDAD DE LOS INHIBIDORES IRREVERSIBLES DE EGFR (AFATINIB)
Afatinib es un inhibidor irreversible de la familia de receptores ErbB que inhibe el receptor del factor de crecimiento epidérmico tipo 1 (ErbB1 o EGFR) tipo 2 (ErbB2 o HER2) y el ErbB4.
El perfil de acontecimientos adversos es similar al de los tratamientos dirigidos contra EGFR, siendo principalmente tipo gastrointestinal y cutáneo.
TABLA 4: PRINCIPAL TOXICIDAD DE AFATINIB
|
AA (dosis 50 mg)
|
Todos los grados (%)
|
Grado 3, n(%)
|
|
DIARREA
|
83,3
|
17,9
|
|
EXANTEMA/ACNÉ
|
72,6
|
13,2
|
|
ESTOMATITIS
|
52,8
|
5,1
|
|
ALTERACIÓN UNGUEAL
|
33,5
|
4,1
|
La diarrea asociada a afatinib suele aparecer normalmente durante las primeras dos semanas de exposición al fármaco. el diagnóstico y el tratamiento precoz de la diarrea son esenciales para evitar tener que disminuir la dosis o el abandono del mismo, por ello se recomienda dar fármacos antidiarreicos al comienzo del tratamiento con una cantidad diaria de líquido de más de dos litros con sales y azúcar para evitar hiponatremia e hipocaliemia.
Los acontecimientos adversos cutáneos incluyen exantema, acné, dermatitis acneiforme y sequedad cutánea. Es importante realizar una adecuada prevención y remitir a un dermatólogo con experiencia en el tratamiento de pacientes sometidos a tratamiento anti-EGFR13.
TOXICIDAD DE AGENTES ANTIANGIOGÉNICOS
GENERALIDADES
El VEGF es un factor predominantemente proangiogénico, que se une a varios receptores endoteliales, principalmente VEGFR-1 y VEGFR-2, desencadenando una cascada de señalización intracelular que permite la proliferación endotelial y la angiogénesis.
El VEGF juega un papel fundamental en diversos procesos fisiológicos como la cicatrización de las heridas y el mantenimiento de la integridad de la mucosa, por ello, su inhibición puede desembocar en distintos efectos adversos, poco frecuentes con los tratamientos quimioterápicos clásicamente utilizados2. Las moléculas que se dirigen específicamente frente a la vía de señalización del VEGF aprobadas actualmente por la FDA y EMEA para el tratamiento de distintos tipos de tumores:
- Bevacizumab: anticuerpo monoclonal recombinante humanizado, que se une al VEGF, evitando su unión al receptor endotelial VEGFR-1 y VEGFR-2. I
- Pequeñas Moléculas Inhibidoras de múltiples receptores tirosin-kinasa (VEGFR-1,2 y 3, PDGFR, KIT, RET, FLT3): Sunitinib, Sorafenib, Pazopanib, Axitinib, Regorafenib.
La principal diferencia entre estos dos grandes grupos de fármacos es la disponibilidad oral de los inhibidores TK frente a los VEGF, que sólo pueden utilizarse por vía intravenosa.
HIPERTENSIÓN Y EVENTOS CARDIOVASCULARES
Hipertensión
Es un efecto de clase de todos los inhibidores de la angiogénesis, tanto de los anticuerpos monoclonales como de los ITK. Es consecuencia del papel principal del VEGF en regular el tono vasomotor y el mantenimiento de la tensión arterial.
Tabla 5: INCIDENCIA DE HIPERTENSIÓN Y ANTIANGIOGÉNICOS
|
FARMACO
|
HTA cualquier grado
|
HTA G3-4
|
|
Bevacizumab
|
32% (26-36%)
|
11-16%
|
|
Sunitinib
|
30%
|
10,3%
|
|
Sorafenib
|
8-14%
|
4-5%
|
|
Pazopanib
|
40%
|
4%
|
|
Axitinib
|
58%
|
15%
|
|
Regorafenib
|
30.4%
|
7.6%
|
RECOMENDACIONES GENERALES:
- Evaluar la TA basal antes de comenzar el tratamiento
- En caso de HTA basal el paciente debe estar controlado antes de iniciar el tratamiento
- Recomendar ESTILO DE VIDA SALUDABLE: ejercicio físico, controlando peso y alcohol moderado
- Informar de la posibilidad de HTA durante el tratamiento y la necesidad de monitorizar durante el mismo
- Formar sobre signos y síntomas de HTA y medir con regularidad
El tratamiento de la hipertensión secundaria al uso de agentes antiangiogénicos, y teniendo en cuenta el mecanismo fisiopatológico de actuación de los mismos,vasoconstricción, consiste en drogas vasodilatadoras. Son de elección: los IECAs, ARA-II o los antagonistas del Calcio.
En el caso de que con la utilización de dos fármacos antihipertensivos a dosis máximas no sea suficiente para la normalización de cifras, o que la hipertensión se acompañe de signos y síntomas de daño orgánico, el tratamiento con inhibidores de angiogénesis deberá ser interrumpido15.
Proteinuria
De forma extraordinaria, el uso de inhibidores de angiogénesis puede desembocar en un síndrome nefrótico o necesitar de hemodiálisis, pero objetivar proteinuria asintomática en los pacientes tratados con estas nuevas drogas no es infrecuente, sobre todo asociado al uso de Bevacizumab.
En la práctica diaria, los pacientes que estén siendo tratados con Bevacizumab requieren monitorización mensual de su proteinuria en orina de 24 horas, de manera que ante aumento progresivo de la proteinuria es necesario la reducción de la dosis de tratamiento y si la proteinuria en orina es mayor a 2 g/24 horas, la interrupción del mismo.
Tromboembolismo cardiovascular y cerebrovascular
Existe un alta incidencia de accidentes isquémicos transitorios (AITs), accidentes cerebrovasculares (ACVs), angina de pecho e infartos de miocardio en pacientes en tratamiento con inhibidores de la angiogénesis, a menudo asociado a hipertensión y daño microvascular largamente mantenido en el tiempo.
Los factores de riesgo más importantes asociados al desarrollo de estos eventos son: la edad superior a 65 años, presentar una historia previa de este tipo de patología y desde el punto de vista fisiopatológico parece ser que el daño endotelial es básico.
Aunque hay datos suficientes para afirmar que el tratamiento anticoagulante combinado con Bevacizumab es seguro, ante la aparición de cualquier evento tromboembólico atribuible a un inhibidor de angiogénesis, las recomendaciones actuales consisten en la interrupción inmediata del tratamiento16.
HEMORRAGIA
El VEGF tiene un papel fundamental en mantener la integridad de los tejidos y la reparación de las heridas, de modo que su inhibición puede interferir en estos procesos fisiológicos, facilitando un retraso en la cicatrización y favoreciendo complicaciones hemorrágicas, así como permitiendo que la integridad tisular se vea amenazada (mucositis).
Debido al retraso producido por Bevacizumab en el proceso de cicatrización de las heridas, no debe usarse dentro de los siguientes 28 días de realización de cirugía mayor16.
El tratamiento con Bevacizumab aumenta el riesgo de hemorragia, habitualmente se trata de episodios de hemorragia menor (grado 1) como epistaxis, que aparecen en un tercio de los pacientes tratados. Sin embargo, en determinados pacientes puede aparecer hemoptisis masiva, por ello, Bevacizumab no debe administrarse nunca en pacientes con historia reciente de hemoptisis de más de media cucharada de sangre roja.
Otros eventos hemorrágicos menos frecuentes son: hemorragia gastrointestinal, subaracnoidea e ictus hemorrágico. Sin embargo, no podemos afirmar que la presencia de metástasis cerebrales aumente el riesgo de sangrado con el uso de antiangiogénicos, ya que en todos los estudios los pacientes con metástasis cerebrales han sido excluidos.
Evidentemente, en el manejo de estas hemorragias severas, una vez resuelto el proceso agudo, es obligatoria la interrupción del tratamiento.
PERFORACIÓN
El uso de inhibidores de la angiogénesis aumenta el riesgo de perforación gastrointestinal (gástrica, intestino delgado o colon). Típicamente se manifiesta como un abdomen agudo, por ello la exploración meticulosa y repetida del paciente con dolor abdominal que está siendo tratado con inhibidores de angiogénesis es obligatoria.
Aunque el mecanismo fisiopatológico no se conoce, sí se han identificado una serie de factores de riesgo: el uso de AINEs, la enfermedad inflamatoria crónica, presentar úlcera gástrica, haber tenido cirugía reciente, haber recibido radioterapia abdominal o tener un cuadro oclusivo secundario al crecimiento tumoral.
Se han descrito casos de perforación intestinal tanto con anticuerpos monoclonales anti-VEGF (Bevacizumab) como con ITK del VEGFR (Sunitinib, Sorafenib), disponiéndose de datos de tasas de perforación con el uso de Bevacizumab en torno al 2 % de los pacientes tratados16.
En cualquier caso, ante la aparición de un evento de estas características, se ha de interrumpir inmediatamente el tratamiento.
MUCOSITIS y DIARREA
El VEGF, como se ha referido anteriormente, tiene un papel fundamental en el mantenimiento y la integridad de los tejidos, así como en la reparación de la mucosa dañada. Por ello, su inhibición puede llevar a lesiones en la mucosa del tracto digestivo Hay una llamativa diferencia de este tipo de toxicidad entre ITK de VEGFR y anticuerpos monoclonales anti-VEGF (Bevacizumab). Parece ser que la alta tasa de mucositis con ITK se debe a la supresión del efecto local que el VEGF ejerce sobre la mucosa del tracto digestivo. De este modo, la incidencia de diarrea con Sunitinib fue del 29% (un 3 % era grado 3-4)19, y del 58% para Sorafenib20. En ocasiones se trata de estomatitis funcional sin lesiones aparentes que mejoran durante el descanso.
Importante: Higiene bucal y enjuagues con colutorios sin alcohol o anestésicos tópicos.
En el caso de diarrea, es importante:
- EDUCAR A PACIENTE: manejo dietético y médico
- Evitar laxantes, fibra y otros factores que contribuyen
- Responde bien a hidratación y antidiarreicos (loperamida)
- Grado 3-4: interrumpir hasta resolución
ASTENIA
La administración de inhibidores de la angiogénesis (tanto ITK de VEGFR como anticuerpos monoclonales anti-VEGF) se asocia con astenia de intensidad leve a moderada, o incremento de su intensidad. Se considera uno de los efectos secundarios más frecuentes en los pacientes tratados con ITK con una frecuencia de aparición del 73% en los pacientes tratados con Sorafenib20, del 51% en los tratados con Sunitinib19-22, del 52% de los tratados con Axitinib23, >30% con Regorafenib18 y del 14% en los tratados con Pazopanib24 pero con una incidencia de astenia G3-4 inferior al 10% en todos los casos.
Aparece entre 2º-3ª semana, puede desaparecer durante el descanso de tratamiento (en caso sunitinib). Es importante evaluar de forma periódica otras causas: hipotioridismo, anemia, hipofosfatemia, dolor, insomnio, depresión y reducir la dosis si AFECTA A CALIDAD DE VIDA
HIPERTRANSAMINASEMIA
Ambos agentes, tanto los ITK de VEGFR como los anticuerpos monoclonales anti-VEGF, pueden producir elevación de cifras de transaminasas, y a veces, hepatotoxicidad limitante de dosis.
Aunque el mecanismo fisiopatológico no está totalmente estudiado, sí que es conocida la función del VEGF en la integridad estructural y funcional del hígado.
Ante cualquier grado 3 o 4 de hipertransaminasemia es obligatorio interrumpir el tratamiento, casi siempre son hipertransaminasemias reversibles, y en caso de proseguir el tratamiento se requerirá reducción de dosis del fármaco causante.
En el estudio fase III de Regorafenib en cáncer de colon (CORRECT) se describieron 3 casos de lesión hepática grave con desenlace fatal (0.3%), En estos pacientes la disfunción hepática se inició dentro de los 2 primeros meses de tratamiento y se caracterizó por un patrón de lesión hepatocelular con elevaciones de las transaminasas más de 20 veces el límite de la normalidad, seguidas de un aumento de la bilirrubina. Las biopsias hepáticas de 2 pacientes mostraron necrosis hepatocelular con infiltración por células inflamatorias18.
COMPLICACIONES NEUROLÓGICAS
El síndrome de leucoencefalopatía posterior reversible (RPLS) con una incidencia de < 0.1 % ha sido descrito con el uso de Bevacizumab. Se trata de un trastorno neurológico que se puede manifestar como cefalea, letargia, confusión, ceguera y otros trastornos neurológicos consecuencia de edematización de la sustancia blanca posterior. Frecuentemente se asocia a hipertensión moderada o severa pero no es preciso para el diagnóstico, el cual se hará mediante técnica de imagen con IRM.
Ante la aparición de RPLS, se debe interrumpir el tratamiento con el inhibidor de la angiogénesis, e iniciar el tratamiento antihipertensivo. Los síntomas suelen mejorar y resolverse en unos días, aunque en algunos pacientes pueden quedar secuelas neurológicas18.
SÍNDROME DE MANO-PIE (EDPP)
La eritrodisestesia palmoplantar (EDPP) o síndrome de mano-pie, se define como eritema doloroso, a menudo precedido de parestesias en palmas de las manos y plantas de los pies, que puede aparecer como efecto secundario con el uso de ITK de VEGFR (tanto con Sunitinib19-22 como con Sorafenib20 y Regorafe-nib18 y menos frecuente con Pazopanib24), no asociándose con el uso de anticuerpos monoclonales anti-VEGF.
Se caracterizan por Lesiones hiperqueratósicas en zonas de presión: molestas y dolorosas, tras 3-4 semanas de tratamiento.
MEDIDAS PREVENTIVAS:
- Antes de iniciar el tratamiento: exploración de pies (podólogo para hiperqueratosis)
- Evitar fricción en áreas de presión e irritantes
- Cremas solares y evitar ropa ajustada
- Tomar el tratamiento de tarde disminuye severidad
El tratamiento consiste en la aplicación de compresas frías, tratamiento con corticosteroides, vitamina B6, vitamina E y Dimetil-sulfóxido al 99% tópico.
- GRADO 1: Cremas emolientes, queratinolíticos y ácido salicílico. No modificar dosis
- GRADO 2: reducir dosis. Anestésicos o corticoides tópicos. Analgesia para dolor
- GRADO 3: Interrumpir y reevaluar a los 7 días. Si desaparece reanudar con escalada dosis
CARDIOTOXICIDAD
La toxicidad cardiaca relevante clínicamente es muy poco frecuente en tratamiento con ITK, siendo la disfunción ventricular izquierda el principal efecto adverso (hasta un 12% de los pacientes con CCRm)19-22 con sunitinib, alcanzando G3-4 en 1-2% de los mismos. No obstante en el 27% de los pacientes tratados con sunitinib presentan disminución de la FEVI.
Las arritmias, incluída la bradicardia y la prolongación de los intervalos PR y QT, se han visto muy rara vez >1%
En el caso del tratamiento con Bevacizumab se ha objetivado un riesgo de Insuficiencia cardiaca congestiva (ICC) grados 2-4 del 1.7%16.
Prevención:
- Antes de comenzar el tratamiento realizar EEG Y FEVI
- Durante tratamiento MONITORIZACIÓN TRIMESTRAL DE FEVI
Tratamiento:
- IECAs y betabloqueantes.
- FUROSEMIDA.
- No utilizar fármacos que prolonguen el intervalo QT (quinolonas, Macrólidos, Ondansetrón, Haloperidol o Antidepresivos tricíclicos.
HIPOTIROIDISMO
El hipotiroidismo, definido como cuadro clínico caracterizado por astenia, cambios tróficos, estreñimiento y letargia, así como alteraciones bioquímicas como la elevación de TSH, es un efecto adverso frecuente secundario al tratamiento con Sunitinib20,22,25-27.
Se ha descrito en pacientes de forma precoz a la primera-segunda semana de iniciar el tratamiento pero la incidencia se incrementa progresivamente con la duración del mismo.
Por lo que respecta al manejo de esta toxicidad, dada la alta frecuencia de hipotiroidismo y los síntomas inespecíficos acompañantes, los pacientes deberían ser monitorizados (TSH y T4) antes del comienzo del tratamiento con Sunitinib y cada 2 o 3 meses, teniendo en cuenta que bajos niveles de TSH en pacientes con leves síntomas de tirotoxicosis puede preceder al establecimiento del hipotiroidismo.
Cuando la clínica del hipotiroidismo se ha establecido, ha de ser tratado; incluso debe ser considerado su tratamiento en aquellos casos con hipotiroidismo subclínico.
TABLA 6. EFECTOS ADVERSOS DE LOS INHIBIDORES DE LA ANGIOGÉNESIS
|
EFECTO ADVERSO
|
BEVACIZUMAB
|
SOREFENIB
|
SUNITINIB
|
PAZOPANIB
|
AXITINIB
|
REGORAFENIB
|
|
HTA
|
SI
|
SI
|
SI
|
SI
|
SI
|
SI
|
|
PROTEINURIA
|
SI
|
NO
|
SI
|
SI
|
SI
|
SI
|
|
EFECTOS TROMBOTICOS
|
SI
|
SI
|
SI
|
SI
|
SI
|
SI
|
|
HEMORRAGIA
|
SI
|
SI
|
SI
|
SI
|
SI
|
SI
|
|
PERFORACION
|
SI
|
SI
|
SI
|
SI
|
SI
|
SI
|
|
ASTENIA
|
SI
|
SI
|
SI
|
SI
|
SI
|
SI
|
|
DIARREA
|
NO
|
SI
|
SI
|
SI
|
SI
|
SI
|
|
EPP
|
NO
|
SI
|
SI
|
SI
|
SI
|
SI
|
|
HIPOTIROIDISMO
|
NO
|
NO
|
SI
|
SI
|
SI
|
SI
|
|
TOXICIDAD CARDIACA
|
NO
|
SI
|
SI
|
SI
|
NO
|
SI
|
TOXICIDAD DE AGENTES ANTI-HER2
Aproximadamente el 20-25 % de los cánceres de mama sobreexpresan el receptor del factor de crecimiento epidérmico EGFR-2 o HER-2 (c-erb B2).
En la actualidad se varios fármacos dirigidos específicamente frente a esta diana molecular, con distinta vía molecular de actuación y distinta indicación en el tratamiento oncológico del cáncer de mama.
TRASTUZUMAB
El trastuzumab es un anticuerpo monoclonal humanizado IgG1, que se une selectivamente y con alta afinidad al dominio extracelular del EGFR-2 o HER-2.
Los efectos secundarios más frecuentes asociados al tratamiento con Transtuzumab son:
Cardiotoxicidad
El ensayo clínico pivotal que dio la aprobación de Trastuzumab en el cáncer de mama metastásico que sobreexpresaba HER-2, se publicó en 2001, siendo la principal toxicidad observada la cardiotoxicidad28. La tasa de disfunción cardíaca tras los resultados de la revisión del CREC fue del 8 % para las pacientes tratadas con antraciclinas, cifra que aumentaba al 27 % cuando se asociaba Trastuzumab a esta combinación; sin embargo, la tasa de disfunción cardíaca del tratamiento con Paclitaxel fue del 1 %, llegando al 13 % al asociar Trastuzumab al tratamiento.
En esta revisión se concluyó que había mayor riesgo de cardiotoxicidad a mayor edad y al asociar Antraciclinas con Trastuzumab29.
Los resultados de los ensayos clínicos con Trastuzumab adyuvante muestran que la combinación de éste con Taxanos administrados de forma secuencial tras la administración de quimioterapia con regimen de antraciclinas, aumenta el riesgo absoluto de insuficiencia cardíaca congestiva sintomática (grado III/IV de la NYHA) entre el 0.6 % en el ensayo HERA y el 4.1 % en el ensayo NSABP B-31.
En contraste con la toxicidad cardíaca de las Antraciclinas (que es irreversible, dosis-dependiente y asocia cambios ultraestructurales), la cardiotoxicidad asociada a Trastuzumab es reversible, idiosincrática y no se asocia con daño estructural.
Por lo que respecta al manejo de la toxicidad, se ha establecido que ante la aparición de insuficiencia cardíaca congestiva se ha de interrumpir definitivamente el tratamiento, y temporalmente cuando se detecte un descenso de la fracción de eyección del 15 % (respecto a nivel basal previo a inicio del tratamiento) o por debajo del 50 %. Trastuzumab puede ser reiniciado a las 4-8 semanas si se comprueba que la FEVI retorna a límites normales y la disminución absoluta respecto a su nivel basal en menor al 15 %.
Hay datos que sugieren que en pacientes con enfermedad metastásica con un descenso significativo de la FEVI, el tratamiento con betabloqueantes o IECAs puede permitir la reintroducción del tratamiento con Trastuzumab, asumiendo por parte de la paciente y del médico responsable el equilibrio riesgo-beneficio29.
Por todo lo expuesto, es muy importante en pacientes que inicien un tratamiento con Trastuzumab realizar una correcta valoración de la función cardíaca previo al inicio del mismo y un seguimiento posterior de la misma. Prestar especial atención a los pacientes en tratamiento adyuvante libres de enfermedad, que hayan recibido regímenes con Antraciclinas y Trastuzumab, ya que la cardiotoxicidad puede aparecer a largo plazo.
Reacciones infusiones
Durante la primera infusión de Trastuzumab, en el 40 % de las pacientes, aparece una reacción consistente en fiebre y escalofríos. Se trata con Paracetamol, resolviéndose el cuadro en la gran mayoría de casos, únicamente la interrupción permanente de Trastuzumab es requerida en < 1 % de pacientes.
Otros signos o síntomas que pueden aparecer durante la reacción infusional son náuseas, vómitos, dolor (habitualmente en la zona tumoral), rigidez, cefalea, disnea, rash y astenia.
En aquellos pacientes que durante la infusión de Trastuzumab experimenten disnea o hipotensión clínicamente significativa, se ha de interrumpir la infusión, y se han de iniciar medidas médicas que incluyan la administración de difenhidramina, broncodilatadores, corticosteroides, oxígeno y epinefrina, si precisa. De forma que, la administración de trastuzumab deberá ser definitivamente interrumpida en los pacientes en los que acontezca una reacción infusional severa.
Toxicidad pulmonar
La incidencia de pneumonitis inducida por trastuzumab se estima en un 0,4 a 0,6 %, esta pneumonitis puede presentarse con una progresión rápida de infiltrados pulmonares y fallo respiratorio tras haber recibido la primera dosis de trastuzumab o después de 6 semanas de tratamiento. La mortalidad de esta complicación se sitúa en torno al 0,1 %.
Otra de las toxicidades pulmonares también registrada con el uso de trastuzumab es la alveolitis neutrofílica aguda y la neumonía organizada tras el tratamiento con trastuzumab.
Otras efectos adversos
Otras toxicidades menos comunes asociadas al uso de trastuzumab han sido la diarrea con una incidencia del 25% y la glomerulopatía, en forma de síndrome nefrótico. Ésta última aparece de forma poco frecuente entre los 4 y los 18 meses tras el inicio del tratamiento.
LAPATINIB
Lapatinib es una pequeña molécula inhibidor tirosin-kinasa (ITK) que presenta una acción doble: inhibe el dominio tirosin-kinasa intracelular de EGFR/ErbB-1 y HER-2/ErbB-2.
La principal toxicidad derivada del uso del Lapatinib, es la gastrointestinal, y más concretamente la diarrea. En el estudio pivotal, la diarrea de cualquier grado ocurrió en el 60 % de los pacientes que recibían tratamiento combinado (lapatinib + capecitabina) frente al 39 % del brazo que recibía capecitabina en monoterapia, la diferencia fue estadísticamente significativa; sin embargo, sólo un 1 % experimentó diarrea G4.
También fue más frecuente la aparición de rash que ocurrió en un 27 % de los pacientes, tratados con la combinación frente a un 15 % en el brazo que recibía capacitaban en monoterapia.
La seguridad cardíaca del fármaco, en base a que se trata de un agente anti-HER2, también ha sido evaluada. Los datos se han recopilado de todos los estudios se ha objetivado un 1,6 % de los pacientes tratados con lapatinib experimentaban una disminución de la FEVI, con una disminución sintomática de la misma en el 0,2 %.
En el estudio fase III que dio la aprobación a lapatinib no hubieron eventos cardíacos sintomáticos, y no se objetivaron diferencias estadísticamente significativas en la caída de la FEVI entre los dos brazos de tratamiento.
TRASTUXUMAB-EMTANSINA
Trastuzumab emtansina, es un conjugado anticuerpo-fármaco dirigido contra HER2 que contiene el anticuerpo monoclonal IgG1 humanizado anti-HER2 trastuzumab, unido mediante enlace covalente al inhibidor microtubular DM1. La conjugación de DM1 a trastuzumab confiere selectividad al agente citotóxico por las células de tumores que sobreexpresan HER2, lo que potencia el transporte intracelular de DM1 directamente hacia el interior de las células malignas. La unión a HER2 causa la internalización de trastuzumab emtansina mediada por el receptor y la consiguiente degradación en lisosomas, lo que da lugar a la liberación de catabolitos citotóxicos que contienen DM1.
De los ensayos clínicos fase II y fase III del fármaco en que un total de 884 han sido tratados con T-DM1 se objetiva que las principales toxicidad observadas fueron: (≥25%) hemorragia (incluido epistaxis), , elevación de transaminasas, astenia, dolor musculoesquelético y cefalea, la mayoría de las cuales grado 1-2. Las RAM de Grado 3 ó 4 más frecuentes (> 2%) fueron trombocitopenia, fatiga, elevación de las transaminasas, anemia, hipopotasemia, dolor musculoesquelético y neutropenia31.
Destacamos elevación de las transaminasas elevaciones en el 28% de los pacientes de los ensayos clínicos. Se notificaron elevaciones de AST y ALT de Grado 3 ó 4 en el 4,1 y el 2,8 % de los pacientes, respectivamente, y normalmente se produjeron en los primeros ciclos de tratamiento.
Se notificó disfunción ventricular izquierda en el 2,0 % de los pacientes de los ensayos clínicos de trastuzumab emtansina. La mayoría de los acontecimientos observados fueron reducciones asintomáticas de la FEVI de Grado 1 o 2. Se notificaron acontecimientos de Grado 3 o 4 en el 0,3% de los pacientes. Estos acontecimientos poco frecuentes de Grado 3 o 4 se produjeron generalmente en los primeros ciclos de tratamiento (1-2). Se recomienda realizar controles adicionales de la FEVI en los pacientes que presenten valores de FEVI ≤ 45 %
Se notificó trombocitopenia en el 31,4 % de los pacientes y fue la reacción adversa más frecuente que requirió la interrupción del tratamiento (1,4 %). La trombocitopenia fue de Grado 1 o 2 en la mayoría de los pacientes, el nadir se alcanzó hacia el día 8 y los recuentos se restablecieron generalmente a Grado 0 o 1 antes de administrar la siguiente dosis planificada.
PERTUZUMAB
Anticuerpo monoclonal recombinante humanizado que se une de forma específica al dominio de dimerización (subdominio II) de la región extracelular del receptor HER2, inhibiendo por consiguiente la dimerización del receptor. Esto implica un mecanismo de acción innovador y único, ya que es capaz de bloquear la heterodimerización dependiente de ligando del receptor HER2 con otros miembros de la familia HER (EGFR/HER1, HER3 y HER4).
Entre los efectos adversos más frecuentes (>50%) objetivados están: diarrea, alopecia y neutropenia. Las RAM de Grado 3-4 más frecuentes (> 10 %) fueron neutropenia, neutropenia febril y leucopenia, y las reacciones adversas más graves fueron neutropenia febril, neutropenia y diarrea32.
Después de 1 año de seguimiento adicional, la disfunción ventricular izquierda ocurrió con una frecuencia <10 %.
En el ensayo pivotal CLEOPATRA, en el primer día cuando sólo se administró pertuzumab, la frecuencia total de reacciones a la perfusión fue del 13,0 % y la mayoría de las reacciones a la perfusión fueron leves o moderadas. Las reacciones a la perfusión más frecuentes (> 1,0 %) fueron fiebre, escalofríos, cansancio, cefalea, astenia, hipersensibilidad y vómitos. La frecuencia total de acontecimientos de hipersensibilidad/anafilaxia del 10,8 % ; de ellas el 2 % fueron de Grado 3-4 En general, la mayoría de las reacciones de hipersensibilidad fueron de intensidad leve o moderada y se resolvieron en el curso del tratamiento32.
La diarrea ocurrió en un 66,8% . La mayoría de los acontecimientos fueron de intensidad leve a moderada y ocurrieron en los primeros ciclos de tratamiento. La incidencia de diarrea de Grado 3-4 fue del 7,9 % y l a mediana de duración del episodio más largo de diarrea fue de 17 días, resolviéndose adecuadamente con antidiarreicos32.
FARMACOS INHIBIDORES DE MECANISMOS DE INMUNOTOLERANCIA
ANTICUERPOS ANTI CTLA-4 (IPILIMUMAB Y TREMELIMUMAB)
Ipilimumab es un anticuerpo monoclonal (IgG1κ) anti-CTLA-4 completamente humano, producido en células de ovario de hámster chino mediante tecnología de ADN recombinante.
Diversos estudios de pool de pacientes de ensayos de fase I a III han demostrado que los efectos adversos inmunológicos ocurren hasta en un 65% de los pacientes en cualquier grado, siendo la mayoría de estos efectos de grado leve o moderado y con una mortalidad inferior al 1%34.
Los órganos diana de esta toxicidad son fundamentalmente el tracto gastrointestinal, el hígado, la piel y los órganos endocrinos34. Además existe un patrón temporal de aparición de estos efectos adversos:
- PIEL: Tras 2-3 primeras semanas de tratamiento
- GI y HEPATICO: 6-7 semanas de tratamiento
- ENDOCRINOPATÍAS: a las 9 semanas
Los efectos adversos grado II a IV se resuelven en el 90% de los casos en un periodo no superior a tres meses con excepción de las endocrinopatías que a veces son definitivas.
El manejo general de las toxicidades autoinmunes asociadas a tratamientos anti CTLA-4 es común a todas:
- LEVES: tratamiento sintomático
- LEVES PERSISTENTES O MODERADOS: Corticoides dosis bajas y salta dosis
- GRAVES: corticoides dosis altas u otros inmunosupresores y fin de tratamiento
TOXICIDAD CUTÁNEA
La toxicidad cutánea es la más frecuentemente reportada en los pacientes tratados con ipilimumab, apareciendo hasta en un 65% de los casos.
Características:
- Aparece tras 3-4 semanas de tratamiento
- Clínica: lesiones maculo-papulares muy pruriginosas
- 2.5% muy graves (Sdr. Stevens Johnson, necrolisis epidérmica tóxica o necrosis cutánea)
TRATAMIENTO:
|
TOXICIDAD LEVE O MODERADA
|
Cremas hidratantes
Antihistamínicos orales
Cremas esteroides baja concentración
|
|
TOXICIDAD GRAVE (G3)
|
Corticoides sistémicos
Retirada del fármaco
|
TOXICIDAD GASTROINTESTINAL
El bloqueo de CTLA-4 ocasiona una alteración de la regulación de la inmunidad de la mucosa gastrointestinal que ocasiona diarrea y colitis e incluso alteraciones en otros puntos del aparato digestivo. La afectación fundamental es del colón descendente. Histológicamente se observa un infiltrado neutrofilico en el 46% de los pacientes, linfocitico en el 15% o mixto en el 38% de los enfermos.
La diarrea se observa en el 44% de los pacientes que reciben dosis de 10 mg/kg, con diarrea de grado III a IV en el 18% de los pacientes. En el estudio de registro de la dosis de 3 mg/kg en segunda línea, la toxicidad gastrointestinal ocurrió entre el 29 y 32.1% siendo de grado III o superior del 5.8 al 7.6%.
Los pacientes se presentan con diarrea, dolor abdominal, rectorragia y aumento de la frecuencia de deposiciones, en ocasiones se asocian otras complicaciones como esofagitis, gastritis o yeyunitis. La colonoscopia muestra ulceras mucosas en los casos severos34.
En la evaluación de estos pacientes con diarrea se realizará diagnóstico diferencial con otras causas como infecciones o enfermedad intestinal inflamatoria y se determinara la enterotoxina del Clostridium difficile.
TRATAMIENTO:
- DIARREA LEVE: Reposición HE y antidiarreicos
- DIARREA PERSISTENTE O MODERADA (G2): interrumpimos tto y tto sintomatico. Si persiste CORTICOIDES dosis bajas
- DIARREA G3-4: STOP tto. Corticoides IV altas dosis y si no mejoría Infliximab
TOXICIDAD HEPÁTICA
- Aparece en un 3 a 9% de los pacientes tratados siendo de grado III o superior en el 1% de los casos .
- Clínicamente suele manifestarse como elevación asintomática de las transaminasas o la bilirrubina aunque en ocasiones esto se acompaña de síntomas sistémicos como fiebre o malestar34.
- El manejo correcto de estos enfermos requiere que se excluyan otras causas de enfermedad hepática como la progresión de la enfermedad, las infecciones víricas, la hepatopatía etílica…
TRATAMIENTO:
En los casos de toxicidad grado I a II se omitirá el ipilimumab hasta que se resuelva y se administraran esteroides a dosis bajas al menos durante 30 días (48).
En las toxicidades grado III a IV se finalizara el tratamiento con ipilimumab y se administraran corticoides a dosis altas por via intravenosa.
ENDOCRINOPATIAS
Son muy raras y se pueden manifestar desde síntomas leves e inespecíficos llegando hasta complicaciones potencialmente mortales. Puede aparecer hipotiroidismo, hipertiroidismo asociado a tiroiditis, hipopituitarismo, hipofisitis, insuficiencia suprarrenal e hipogonadismo34.
La hipofisitis es el trastorno endocrinológico más frecuentemente asociado a ipilimumab ocurriendo en entre un 1 y un 6% de los pacientes que reciben tratamiento34. Se supone que es producida por la infiltración linfocítica de la hipófisis seguida del daño a las células productoras de hormonas. Clínicamente se manifiesta por cefalea, mareo, debilidad y alteraciones visuales y se suele producir más allá de seis semanas después de haber comenzado el tratamiento con ipilimumab. La IRM con gadolinio muestra un hipófisis aumentada de tamaño y heterogénea siendo estos hallazgos inespecíficos .
Las toxicidades de grado I a II sin crisis adrenal y mínimamente sintomáticas se pueden vigilar de forma estrecha o bien comenzar con dexametasona a dosis de 16 mg junto con terapia hormonal sustitutiva según las necesidades como se hace en las de grado III o superior. La mediana de tiempo hasta la resolución puede ser superior a 20 semanas y por tanto el tratamiento sustitutivo necesario durante ese prolongado periodo de tiempo. Aunque algunos pacientes recuperan la función hipofisaria en algunas ocasiones la toxicidad es irreversible.
TOXICIDAD DE LOS ANTICUERPOS ANTI PD-1
Anti-PD-1 es un anticuerpo completamente humano que se dirige contra el receptor inhibidor expresado en los linfocitos T activados, llamado PD-1 o muerte programada-1. Todavía pendiente de completar estudios clínicos.
En los ensayos fase I y II realizados hasta el momento se ha observado que la toxicidad de este grupo de fármacos es muy similar a la de ipilimumab. Los efectos adversos atribuibles al tratamiento que aparecieron con más frecuencia fueron, fatiga, rash, diarrea, prurito, pérdida de apetito y nauseas35. Los efectos adversos de grado III-IV que se consideraron relacionados con autoinmunidad fueron, neumonitis, vitíligo, colitis, hepatitis, hipofisitis y tiroiditis. El manejo la hepatitis y de la diarrea fue similar al realizado con ipilimumab con interrupción del tratamiento y glucocorticoides cuando eran necesarios. En el caso de las encocrinopatias además se añadió tratamiento hormonal sustitutivo. La neumonitis apareció en un 3% de los pacientes siendo de grado III o IV en un 1%35.
OTRAS MOLÉCULAS
IMATINIB MESYLATO
Imatinib es un inhibidor selectivo de la señal de trasnducción capaz de inhibir los receptores de tirosin-kinasa BCR-ABL, C-KIT y PDGF (factor de crecimiento derivado de plaquetas) .Los efectos secundarios más frecuentes producidos por Imatinib son36:
6.1.1 Toxicidad no hematológica
El Rash fue el efecto adverso reportado en todos los estudios analizados con frecuencia 20-66%, siendo unos de los efectos no hematológicos más frecuentes. Además del Rash se han objetivado otras toxicidades cutáneas asociadas al tratamiento con Imatinib, como son: la hiperpigmentación o hipopigmentación de la piel y el cuero cabelludo, la siringometaplasia escamosa ecrina, la pitriasis rosada de Gilbert y el riesgo más elevado de sufrir infección por herpes zoster.
La toxicidad gastrointestinal más frecuentemente asociada al tratamiento con Imatinib fueron: nauseas (43-55%), diarrea (25-32%); vómitos (17-41%), dispepsia (18%) y estreñimiento (8.5%) de los pacientes.
El edema superficial, generalmente periorbitario es el efecto secundario más frecuentemente observado en los pacientes tratados con Imatinib. Aparece en 13-50% de los mismos. Otros edemas menos frecuentemente observados son: derrame pericárdico, edema pulmonar, ascitis, anasarca y edema cerebral.
Las algias son también efectos adversos frecuentemente asociados al tratamiento con Imatinib, consistente en dolor abdominal (27%), artralgias (13-28%), mialgias (21%) y dolores óseos.
Toxicidad hematológica
La toxicidad hematológica más frecuentemente observado: neutropenia 37.6%, trombocitopenia 20.4% y anemia 9.3%.
INHIBIDORES DE M-TOR (TEMSIROLIMUS, EVEROLIMUS)
Los efectos tóxicos más frecuentemente observados37 (> 30%) en el tratamiento con ambos inhibidores fueron: rash, astenia, mucositis, nauseas, edemas y anorexia: La alteraciones de laboratorio más frecuentes (> 30%) fueron: anemia, hiperglucemia, hiperlipemia e hipercolesterolemia37.
Reacciones de hipersensibilidad: manifestadas como anafilaxia, disnea, flushing y dolor precordial, son el efecto secundario más frecuentemente asociado con la infusión de Temsirolimus, siendo necesario premeditar al paciente con antihistamínicos (difenhidramina) 30 minutos antes de la infusión.
Rash cutáneo: Toxicidad más común, apareciendo en 47-76% de los pacientes tratados con Temsirolimus y en 25-50% de los tratados con everolimus.
Características: Inicio primeras 2 semanas.Rash maculo-papular o acneiforme. En ocasiones: xerosis, eccema, cambios en color de piel.Puede haber o no prurito.
Manejo:
Prevención: crema emoliente con fotoprotección.
Tratamiento exfoliante:
o Peróxido Benzoílo gel 5% (oxyderma ®)1-2 v/día Tópico
o Tretinoina crema (Retirides ®) 1 v/día Tópico
Antibiótico:
o Eritromicina Sol 2% o Toall unidosis 2v/día Tópico.
o Clindamicina Sol 1% (Dalacin tópico ®) 2v/día
Si no hay mejoría: Tto vía oral con:
o Doxiciclina 100mg/24h 12 ss
o Minociclina 100mg/12h 12 ss
Si prurito: anti-histamínicos VO
Mucositis: Aparición temprana: 1ª semana de 1ª dosis. Dosis de pendiente. Se caracteriza por lesiones aftosas, pequeñas y superficiales con un halo eritematoso periférico. Localizada frecuentemente en labios, lengua y paladar blando. No pseudomembrana, típica de mucositis por QT o RT.
Manejo:
o Medidas generales
o Tratamiento:
• Clobetasol gel 0,05% top 2 v/día o
• Dexametasona 0.1 mg/mL sol 2veces/día.
o Si sobreinfección fúngica:
• Nistatina enjuagues, Fluconazol o clotrimazol.
o G4: Si no hay mejoría, discontinuar tratamiento
Toxicidad gastrointestinal en forma de mucositis o diarrea apareció en el 30-40% de los pacientes pero menos del 3% presentaron grado 3-4. El tratamiento de la diarrea es similar al del resto de fármacos: adecuada hidratación, dieta astringente, loperamida…
La astenia apareció en el 50% de los pacientes tratados con ambos fármacos, de los cuales el 11% presentaron grado 3-4.
Neumonitis intesrticial: se ha objetivado hasta 29% de los pacientes tratados con Temsirolimus37 y 13% de los tratados con everolimus, siendo hasta un 15% grado 3-4 en el tratamiento con Temsirolimus que solo se objetiva en un 3% con everolimus38.
Característicamente suele aparecer tras 3 meses de tratamiento y la mayoría son asintomáticas.Loa síntomas más comunes son: tos, disnea y fatiga.
Desde el punto de vista radiológico se caracteriza por Opacidades en “vidrio deslustrado,. reticulares y/o consolidaciones que afectan a más de 1 lóbulo y predominan los inferiores (subpleural). Es menos frecunete el patrón peribroncovascular.
Tratamiento:
|
NEUMONITIS
|
GRADO 1
ASINTOMÁTICA
|
GRADO 2
Tos leve-moderada
|
GRADO 2
TOS moderada-severa
|
GRADO 3 -4
INGRESO, UCI
|
|
MONITORIZACIÓN
|
Clínica: 2 sem
|
Clínica: 2 sem
Rx tórax: 4 sem
|
Clínica: 1sem
Rx: 2 semanas
|
|
|
TRATAMIENTO
|
No ajuste dosis
|
Igual; No ajuste
Peor: ajuste dosis
|
Reducción dosis
No mejoría: corticoides
|
CORTICOIDES IV
RETIRADA M-TOR
|
TRASTORNOS METABÓLICOS:
Hiperglucemia: El uso de Temsirolimus se asocia con un 89% de elevación de la glucosa sérica de los cuales 26% presentaron hiperglucemias mantenidas y un 50% durante el tratamiento con everolimus, pero siendo < 12% grado 3-4. Importante valorar las cifras de glucemia del paciente antes y durante el tratamiento, educación sobre estilo de vida saludable, síntomas y control de glucemias y avisar al mismo de la probable necesidad de modificación de antidiabéticos orales o insulina, si se trata de un diabético conocido37.
Hiperlipemia: El uso de Temsirolimus se asocia con aumento de las cifras de colesterol y triglicéridos del 24-27%, siendo superior con el uso de Everolimus38 hasta 75% , siendo 1% grado 3-4. Importante valorar las cifras de colesterol y triglicéridos previo al comienzo del tratamiento y cada3-4 semanas, durante el mismo.
INHIBIDORES DE PROTEOSOMA (BORTEZOMIB)
Las principales toxicidades obtenidas de los estudios pivotales fueron: la astenia (61 %), diarrea (57 %), estreñimiento (42 %), neuropatía periférica (36 %), trombocitopenia (35 %), pirexia (35 %), vómitos (35 %) y anemia (26 %).
Como toxicidad reseñable con el uso de bortezomib, destacar la reactivación de la infección por virus herpes zoster y herpes simple, documentada en un 13 % de los pacientes que recibieron este tratamiento.
INHIBIDORES DE B-RAF (VEMURAFENIB)
Vemurafenib está indicado en monoterapia para el tratamiento de pacientes adultos con melanoma no resecable o metastásico con mutación de BRAF V600 positiva.
Las prinicipales toxicidadades asociadas al tratamiento con vemurafenib en los ensayos clínicos fueron: cutáneos, artralgia y astenia. Se objetivaron reacciones cutáneas de fotosensibilidad grado 2-3 hasta en el 12% de los pacientes39.
Carcinomas cutáneos: Se han notificado casos de Carcinoma de células escamosas en pacientes tratados con vemurafenib. La incidencia en todos los estudios fue aproximadamente del 20%. La mayoría de las lesiones extirpadas, analizadas por un laboratorio central independiente para su evaluación patológica, fueron clasificados como un subtipo de carcinoma de células escamosas (CCE)- queratoacantoma o caracterizados como queratoacantoma mixto (52%). Se manifestó normalmente al comienzo del tratamiento con un tiempo medio hasta la primera aparición de entre 7 y 8 semanas. Los casos fueron normalmente tratados mediante una simple extirpación quirúrgica y los pacientes generalmente continuaron con el tratamiento sin modificar la dosis.
Reacciones de hipersensibilidad: Se han notificado reacciones graves asociadas con vemurafenib incluyendo anafilaxia. Las reacciones graves de hipersensibilidad pueden incluir el síndrome de Stevens-Johnson, rash generalizado, eritema o hipotensión. En los pacientes que experimenten reacciones graves de hipersensibilidad, se debe interrumpir permanente el tratamiento.
Prolongación del intervalo QT: puede dar lugar a un aumento del riesgo de arritmias ventriculares, incluyendo Torsade de Pointes. No se recomienda el tratamiento con vemurafenib en pacientes con alteraciones no corregibles de los parámetros electrolíticos (incluyendo el magnesio), con síndrome de QT largo o que están tomando medicamentos, de los que se conoce que prolongan el intervalo QT25.
Antes del tratamiento con vemurafenib, después de un mes de tratamiento y tras la modificación de la dosis, se debe controlar el electrocardiograma (ECG) y los electrolitos (incluyendo el magnesio) en todos los pacientes.
INHIBIDORES ALK (CRIZOTINIB)
Crizotinib es una molécula pequeña, inhibidor selectivo del receptor tirosina-quinasa (RTK) ALK y sus variantes oncogénicas (es decir, eventos de fusión de ALK y mutaciones seleccionadas de ALK). Crizotinib inhibe también la actividad tirosina-quinasa del receptor del factor de crecimiento de los hepatocitos (HGFR, c-Met).
Indicado para el tratamiento de adultos con carcinoma de pulmón no microcítico (CPNM) avanzado, positivo para la quinasa del linfoma anaplásico (ALK), previamente tratado.
La reacciones adversas de cualquier grado más frecuentes (>20%) obtenidas de los pacientes que participaron en los ensayos fueron trastornos de la visión, náuseas, diarrea, vómitos, edema, estreñimiento y cansancio. Las reacciones adversas de grado 3 ó 4 más frecuentes (≥3%) en ambos estudios fueron aumento de la ALT y neutropenia40.
Destacar que presentaron trastornos de la visión, tales como diplopia, fotopsia, visión borrosa, alteración de la visión y moscas volantes, 61% de los pacientes del estudio A y el 57% de los pacientes del estudio B. Estos eventos se notificaron como leves (96%), moderados (3%) y graves (<1%) con una mediana de tiempo hasta el comienzo de 15 días en el estudio A y de 6 días en el estudio B.
Se debe destacar por su gravedad, que Crizotinib se ha asociado a casos de neumonitis de carácter grave, potencialmente mortal o mortal relacionada con el tratamiento, con una frecuencia del 1% en cada uno de los estudios. Todos estos casos se produjeron en el plazo de los 2 meses siguientes al comienzo del tratamiento. Se debe monitorizar a los pacientes con síntomas pulmonares indicativos de neumonitis. Debe interrumpirse el tratamiento si se sospecha neumonitis.
Se ha observado prolongación del intervalo QTc, que puede dar lugar a un incremento en el riesgo de taquiarritmias ventriculares (por ejemplo, Torsade de Pointes) o muerte súbita. El riesgo de prolongación del intervalo QTc puede aumentar en pacientes en tratamiento concomitante con antiarrítmicos y en pacientes con enfermedad cardiaca relevante pre-existente, bradicardia o alteraciones electrolíticas.
TOXICIDAD DE AGENTES ANTI-CD20. RITUXIMAB
Rituximab es un anticuerpo monoclonal quimérico humano-murino, cuya diana molecular a la que se une es el antígeno CD20. Rituximab produce una rápida eliminación de la circulación de las células B, de tal forma que los niveles de células B tardan una media de 12 meses en volver a la normalidad tras finalización del tratamiento.
En conjunto, la toxicidad del rituximab en combinación con quimioterapia es bien tolerada, y a excepción de la reacción infusional y la mayor toxicidad hematológica, no añade mucha más toxicidad relevante al régimen de quimioterapia utilizado33.
REACCIÓN INFUSIONAL
La reacción infusional asociada a Rituximab de intensidad leve-moderada, y que consiste en fiebre y escalofríos, ocurre en la mayoría de pacientes durante la perfusión del fármaco; de hecho, se ha objetivado hasta en el 77 % de los mismos durante la primera infusión, disminuyendo en subsiguientes infusiones, siendo del 14 % en la octava.
Otros síntomas frecuentes que pueden ocurrir durante la infusión de Rituximab son:náuseas, astenia, hipotensión, prurito, cefalea, broncoespasmo, rinitis, mialgias y urticaria. Generalmente, ocurren entre los 30 y los 120 minutos tras haber iniciado la infusión, y se resuelven disminuyendo la velocidad de perfusión o interrumpiendo la misma, precisando en ocasiones de medidas de soporte farmacológico.
INFECCIONES
Rituximab induce depleción de células B en el 70 a 80 % de los pacientes con LNH, asociándose con una disminución de inmunoglobulinas séricas en un mínimo número de ellos. Es por eso, que el tratamiento con Rituximab, puede predisponer a infecciones.
La incidencia de eventos infecciosos fue del 31 %. Procesos infecciosos graves (grado 3 o 4) incluyendo sepsis, se dieron en un 2 % de pacientes.
Especial atención y cuidado se ha de tener en pacientes hepatitis B positivos, ya que se han registrado casos de reactivación de virus de hepatitis B, con hepatitis fulminante y fallo hepático, tras el tratamiento con Rituximab, siendo la mediana de tiempo de diagnóstico de hepatitis de 4 meses tras el inicio de Rituximab36. Es por ello que los pacientes portadores de VHB (virus hepatitis B) deberían ser seguidos y monitorizados analíticamente durante el tratamiento y varios meses después de finalizarlo. Ante aparición de reactivación de VHB, el tratamiento con Rituximab deberá ser interrumpido inmediatamente e iniciarse la terapia antiviral correspondiente33.
DICCIONARIO
Éstos son términos que usted puede escuchar del equipo que le atiende:
Alopecia: pérdida del cabello, por lo general temporal, como resultado del uso de los medicamentos de quimioterapia.
Anemia: cantidad baja de glóbulos rojos. Los síntomas de la anemia incluyen cansancio, debilidad y dificultad para respirar.
Anticuerpo: tratamiento biológico distinto de la quimioterapia que se utiliza también para el tratamiento del cáncer, generalmente en asociación con algún tipo de quimioterapia.
Antiemético: fármaco para prevenir o controlar las náuseas y los vómitos.
Biopsia: procedimiento diagnóstico que consiste en la extracción de una muestra de tejido para examinarla al microscópio.
Cáncer: un término generalizado para más de 100 enfermedades en las cuales las células anormales crecen sin el control normal. También se usa para referirse a un tumor maligno o neoplasia.
Catéter: tubo fino y flexible. Se usa para introducir líquidos en el cuerpo o para extraer líquidos del interior del cuerpo.
Catéter venoso central: tubo especial delgado y flexible colocado en una vena principal, generalmente en el tórax o el cuello, que permanece allí el tiempo que sea necesario para introducir líquidos o extraer sangre.
Estomatitis: semejante a mucositis: irritación o llagas en la mucosa de la boca.
Ensayos clínicos: estudios de investigación médica llevados a cabo en pacientes de forma voluntaria. Cada ensayo está diseñado para encontrar la respuesta a preguntas científicas y para encontrar mejores métodos de detectar, prevenir o tratar los problemas de salud.
Factores de crecimiento: también conocidos como factores de estimulación de colonias, estos factores son sustancias que estimulan la producción de células de la sangre en la médula ósea. En caso de que sean necesarios, pueden utilizarse para intentar ayudar al tejido que forma la sangre a recuperarse de los efectos de la quimioterapia y de la radioterapia.
Glóbulos blancos: células de la sangre que combaten la infección.
Glóbulos rojos: células que distribuyen el oxígeno a todos los tejidos del cuerpo.
Hormonas: sustancias naturales liberadas por una glándula de nuestro organismo o administradas como tratamiento, que pueden controlar la función de otros órganos del cuerpo, por ejemplo las hormonas sexuales (estrógenos, progesterona, testosterona), la insulina, la cortisona, etc... Algunas de ellas o sus antagonistas pueden utilizarse para el tratamiento de algunos tipos de cáncer (mama, próstata).
Infusión: administración intravenosa lenta o prolongada de un medicamento o suero.
Intramuscular (IM): dentro de un músculo.
Intratecal (IT): dentro del líquido cefalorraquideo.
Intravenoso (IV): a través de la vena.
Inyección: el uso de jeringa y aguja para introducir líquidos o medicamentos en el cuerpo.
Médula ósea: el tejido esponjoso en el interior de los huesos donde se producen las células de la sangre.
Metástasis: la diseminación de las células tumorales a zonas del cuerpo distantes a través del sistema linfático o del torrente sanguíneo.
Náusea: es una sensación de malestar o de estómago revuelto asociada a la sensación de tener necesidad de vomitar (aunque frecuentemente el vómito no se da).
Neuropatía periférica: condición del sistema nervioso que generalmente empieza con síntomas de entumecimiento, hormigueo, ardor o debilidad en las manos o los pies. Puede ser causada por ciertos medicamentos de quimioterapia.
PET / TEP (tomografía por emisión de positrones): técnica no invasiva de diagnóstico, se basa en detectar y analizar la distribución que adopta en el interior del cuerpo un radioisótopo administrado a través de una inyección.
Plaquetas: también denominadas trombocitos, son pequeñas células que circulan en la sangre y que intervienen en la coagulación, impidiendo hemorragias.
Quimioterapia: familia de medicamentos usados para tratar el cáncer y otras enfermedades proliferativas o neoplasias.
Radioterapia: el uso de radiaciones ionizantes para tratar tumores. Existen varios tipos de radiaciones y de técnicas de administración.
Recuento de células sanguíneas o hemograma: el número de glóbulos rojos, glóbulos blancos y plaquetas en una muestra de sangre.
Remisión: la desaparición parcial o total de los signos y síntomas de la enfermedad.
TAC / Scanner (Tomografía axial computarizada): utilización de rayos X para obtener imágenes muy precisas del interior del organismo y de sus diferentes estructuras.
Terapia: tratamiento. Puede ser farmacológico o de otro tipo.
Terapia adyuvante: tratamiento usado además del tratamiento principal. Se refiere usualmente a terapia hormonal, quimioterapia, radioterapia o inmunoterapia aplicadas después de la cirugía para aumentar las probabilidades de curar la enfermedad o disminuir el riesgo de recaída.
Terapia neoadyuvante: terapia (quimioterapia, terapia hormonal, o radioterapia) administrada antes de la cirugía para reducir el tamaño del tumor.
Tópico: aplicado directamente en la piel.
Tumor: el crecimiento anormal de células o tejidos. Los tumores son benignos (no cancerosos) o malignos (cancerosos).
Vómito: también llamado emesis, es la expulsión violenta y espasmódica del contenido del estómago a través de la boca.
BIBLIOGRAFÍA
- Sawyers C. Targeted cancer therapy. Nature, 2004; 432: 294-297.
- Widakowich C, De Castro G, Azambuja E,, Dinh P, Awada A Review: Side Effects of Approved Molecular Targeted Therapies in Solid Cancers. Oncologist 2007; 12:1443-55
- Segaert S, Van Cutsem E. Clinical signs, pathophysiology and management of skin toxicity during therapy with epidermal growth factor receptor inhibitors. Annals of Oncology, 2005; 16: 1425-1433.
- Pinto C, Barren CA, Girolomoni G, Russi EG, Merlano MC, Ferrari D et al. Management of Skin Toxicity Associated with Cetuximab Treatment in Combination with Chemotherapy or Radiotherapy. Oncologist 2011;16:228-238
- Lynch T, Kim S, Eaby B, Garey J, West D, Lacouture E. Epidermal growth factor receptor inhibitor-associated cutaneous toxicities: an evolving paradigm in clinical management. Oncologist, 2007; 12: 610-621.
- Cappuzzo F, Bartolini S, Ceresoli GL, Tamberi S, Spreafico A, Lombardo L et al. Efficacy and tolerability of gefitinib in pretreated elderly patients with advanced non-small-cell lung cancer (NSCLC). Br J Cancer, 2004; 90: 82-86.
- Schrag D, Chung KY, Flombaum C, Saltz L. Cetuximab therapy and symptomatic hypomagnesemia. J Natl Cancer Inst, 2005; 97: 1221-1224.
- Inoue A, Saijo Y, Maemondo M, Gomi K, Tokue Y, Kimura Y et al. Severe acute interstitial pneumonia and gefitinib. Lancet, 2003; 361: 137-139.
- Herbst RS, Prager D, Hermann R, Fehrenbacher L, Johnson BE, Sandler A et al. TRIBUTE: a phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol. 2005; 23: 5892-5899.
- Sane DC, Anton L, Brosnihan KB. Angiogenic growth factors and hypertension. Angiogenesis, 2004; 7: 193-201
- Wu S, Chen JJ, Kudelka A, Lu J, Zhu X. Incidence and risk of hypertension with sorafenib in patients with cancer: a systematic review and meta-analysis. Lancet Oncol. 2008; 9: 117-123.
- Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004; 350: 2335-2342..
- Grothey A, Van Cutsem E, Sobrero A, Siena S, Falcone A, Ychou M et al. CORRECT Study Group.Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381:303-312
- Bhojani N, Jeldres C, Patard JJ, Perrotte P, Suardi N, Hutterer G, et al. Toxicities associated with the administration of sorafenib, sunitinib, and temsirolimus and their management in patients with metastatic renal cell carcinoma. Eur Urol 2008; 53:918-930
- Motzer RJ, Hutson TE, Tomczak P, Michaelson MD, Bukowski RM, Rixe O et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med. 2007; 356: 115-124.
- Kollmannsberger C, Soulieres D, Wong R, Scalera A, Gaspo R, Bjarnason G. Sunitinib therapy for metastatic renal cell carcinoma: recommendations for management of side effects.Can Urol Assoc J. 2007;1(2 Suppl):S41-54.
- Escudier B and Gore M. Axitinib for the management of metastatic renal cell carcinoma. Drugs R D. 2011;11(2):113-26
- Sternberg CN, Davis ID, Mardiak J, Szczylik C, Lee E, Wagstaff J, et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial.J Clin Oncol 2010;28;1061-1068
- Schwandt A1, Wood LS, Rini B, Dreicer R. Management of side effects associated with sunitinib therapy for patients with renal cell carcinoma. Onco Targets Ther. 2009;2:51-61.
- Rini BI, Tamaskar I, Shaheen P, Salas R, Garcia J, Wood L et al. Hypothyroidism in patients with metastatic renal cell carcinoma treated with sunitinib. J Natl Cancer Inst. 2007; 99:81-83.
- Slamon D, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med. 2001; 344: 783-792.
- Seidman A, Hudis C, Pierri MK, Shak S, Paton V, Ashby M et al. Cardiac dysfunction in the trastuzumab clinical trials experience. J Clin Oncol. 2002;20:1215-1221.
- Geyer CE, Forster J, Lindquist D, Chan S, Romieu CG, Pienkowski T et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med. 2006; 355: 2733-2743.
- Verma S, Miles D, Gianni L, Krop IE, Welslau M, Baselga J et al; EMILIA Study Group. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012; 367(19):1783-91
- Miles D, Baselga J, Amadori D, Sunpaweravong P, Semiglazov V, Knott A et al. Treatment of older patients with HER2-positive metastatic breast cancer with pertuzumab, trastuzumab, and docetaxel: subgroup analyses from a randomized, double-blind, placebo-controlled phase III trial (CLEOPATRA).Breast Cancer Res Treat. 2013; 142(1):89-99.
- Kimby E. Tolerability and safety of rituximab. Cancer treat rev. 2005; 31: 456-473.
- Weber JS, Kähler KC, Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab. J Clin Oncol 2012; 30:2691-7
- Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC, McDermott DF et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med. 2012; 366:2443-54.
- Moen MD, Mckeage K, Plosker GL, Siddiqui MA. Imatinib: a review of its use in chronic myeloid leukaemia. Drugs 2007; 67: 299-320.
- Hudes G, Carducci M, Tomczak P, Dutcher J, Figlin R, Kapoor A et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med. 2007; 356: 2271-2281
- Motzer RJ, Escudier B, Oudard S, Hutson TE, Porta C, Bracarda S et al; RECORD‐1 Study Group.Phase 3 trial of everolimus for metastatic renal cell carcinoma : final results and analysis of prognostic factors. Cancer 2010;116:4256-4265
- Sosman JA, Kim KB, Schuchter L, Gonzalez R, Pavlick AC, Weber JS et al. Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib. N Engl J Med. 2012 ;366(8):707-14
- Shaw AT, Kim DW, Nakagawa K, Seto T, CrinóL, Ahn MJ et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med. 2013;368(25):2385-94