Los Avances en Cáncer Renal
- De forma reciente y por primera vez en el contexto adyuvante, se ha demostrado que pembrolizumab impacta en la supervivencia global.
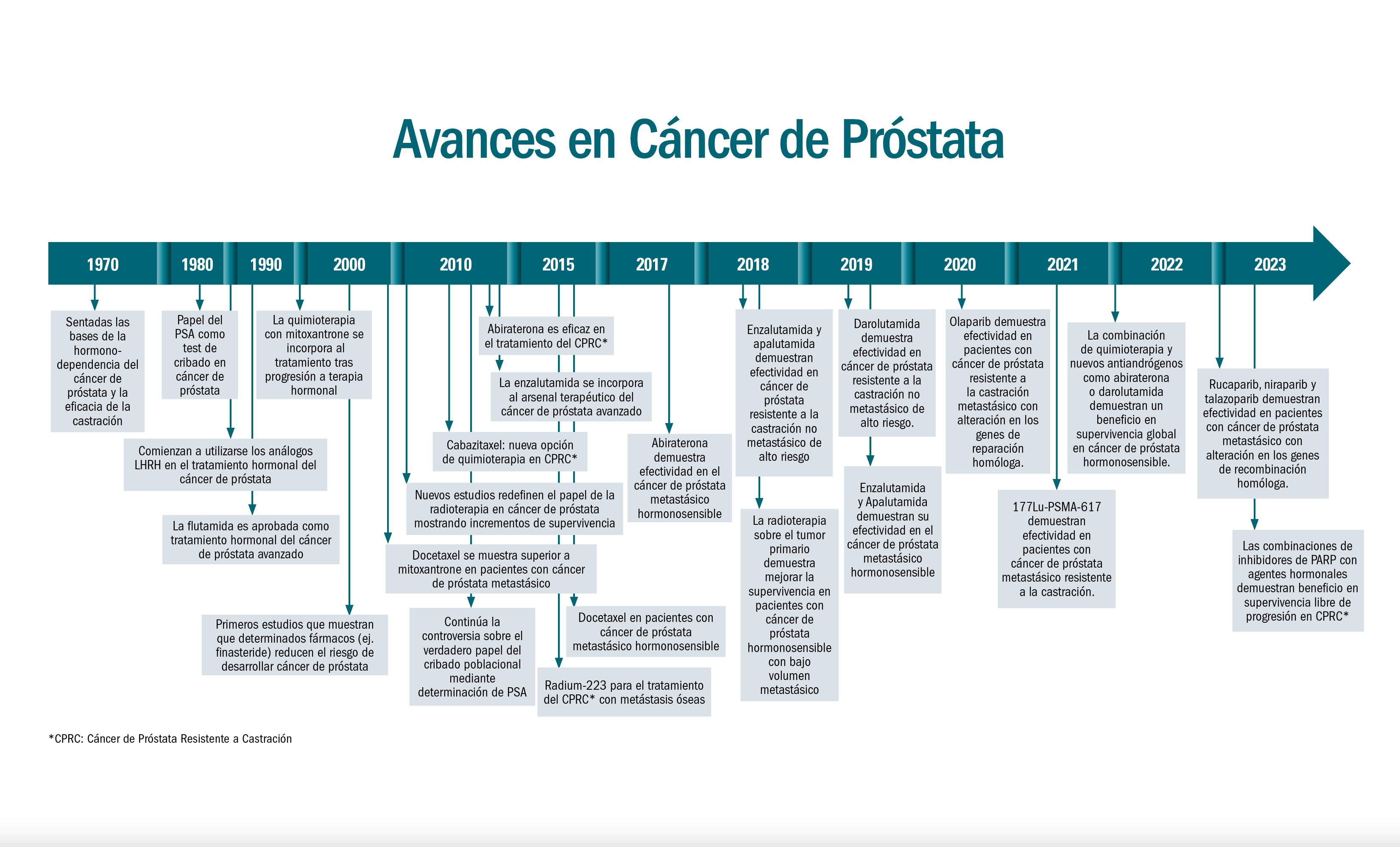
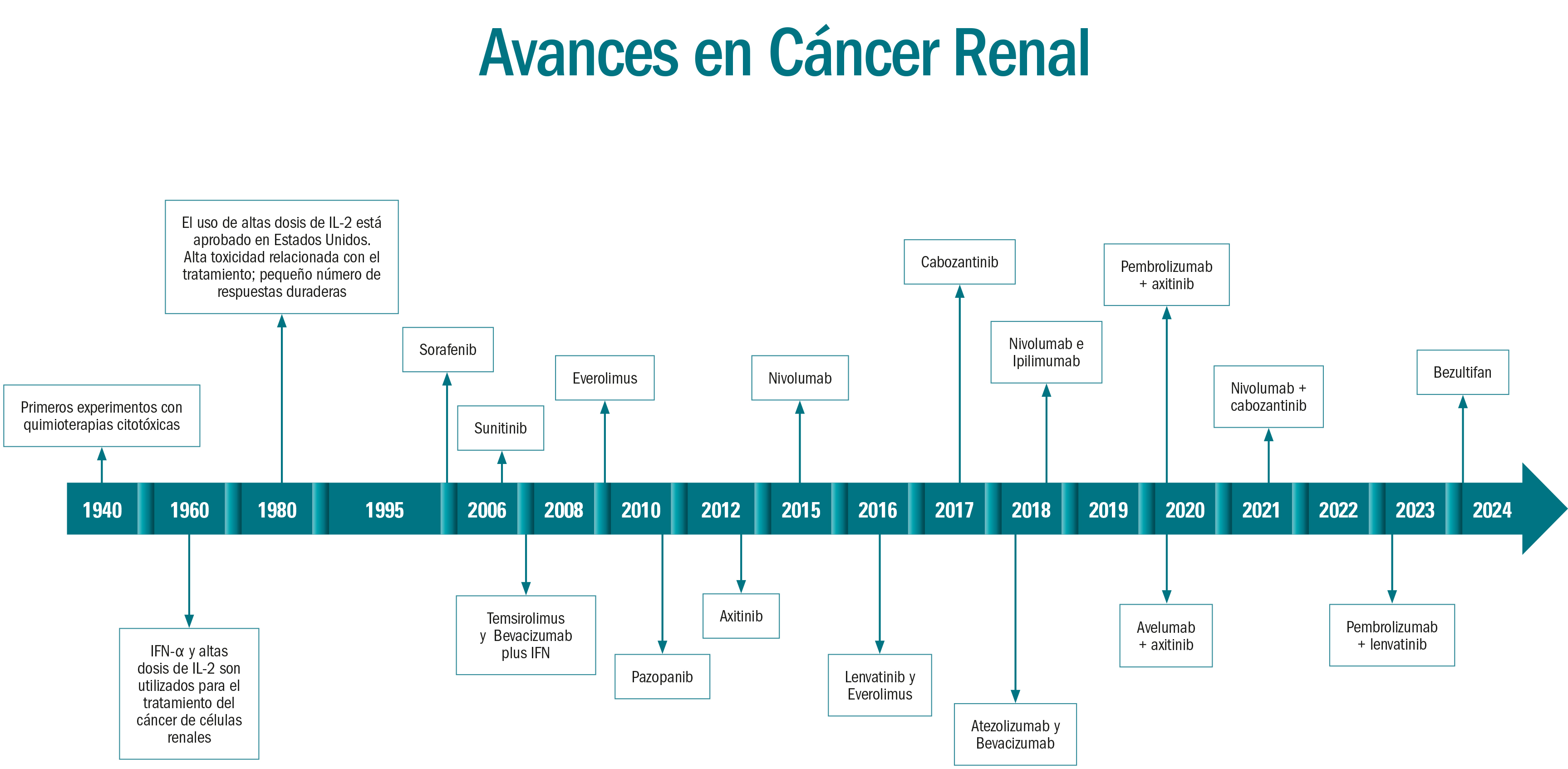
- Hace 15 años, el tratamiento con Interferon o cirugía aislada solo lograba medianas de supervivencia de en torno a cinco meses de supervivencia para los pacientes con enfermedad avanzada. A día de hoy, la secuenciación terapéutica de nuevos fármacos es capaz de proyectar medianas de supervivencia superiores a los 40 meses.
- El cáncer de riñón representa el octavo tipo tumoral en cuanto a prevalencia en España. Cada año se diagnostican en nuestro país más de 9.000 casos nuevos, siendo aproximadamente el doble de frecuente en varones que en mujeres.
Si hace 15 años el tratamiento de pacientes con carcinoma de células renales (CCR) avanzado con Interferon o cirugía aislada como herramienta terapéutica era capaz de lograr medianas de supervivencia de 5-7 meses, en la actualidad la secuenciación terapéutica de nuevos fármacos consigue proyectar medianas de supervivencia superiores a los 40 meses, manteniendo una buena calidad de vida para el paciente. Por otra parte, pembrolizumab, un anticuerpo monoclonal anti-PD1, ha demostrado un impacto positivo en la supervivencia global de pacientes en el contexto adyuvante. Este hito marca una mejora notable en el pronóstico de los pacientes.
En el marco de la campaña de comunicación “En Oncología cada AVANCE se escribe en Mayúsculas”, SEOM da a conocer la evolución y los avances médicos que se han sucedido en estas últimas décadas en el tratamiento de los diferentes tumores. Coincidiendo con el Día Mundial del Cáncer de Riñón que se celebra este jueves, 20 de junio, destacamos los avances más importantes en cáncer de riñón, que representa el 3% de todos los tumores, y aproximadamente tres de cada cuatro neoplasias renales serán carcinomas de células claras. Es aproximadamente dos veces más frecuente en hombres que en mujeres y la edad media de presentación es a los 64 años.
Se estima, además, que es responsable de la muerte de más de 52.000 personas al año en Europa, con 9.208 casos nuevos/año en España. El hallazgo incidental u ocasional de los tumores renales en pacientes asintomáticos ha pasado a ser la principal vía de diagnóstico, lo cual contribuye a la detección de tumores renales en estadios mucho más precoces y, en definitiva, mejora a su vez el pronóstico de esta enfermedad.
El tratamiento del CCR se ha modificado en gran medida en los últimos años. Además de los constantes avances en el tratamiento local radical de los tumores renales en estadio precoz, de forma reciente se ha demostrado que el tratamiento adyuvante con pembrolizumab en pacientes con carcinoma renal con riesgo intermedio/alto (según los
criterios del estudio KN-564) tras nefrectomía y en pacientes con nefrectomía radical y resección de enfermedad metastásica (M1 sin evidencia de enfermedad) aumenta la supervivencia global.
Además, el mejor conocimiento de la biología molecular del carcinoma de células renales avanzado ha permitido identificar vías de señalización que juegan un papel relevante en la progresión de estos tumores.
En este sentido, se sabe que las vías de regulación de los procesos de angiogénesis están alteradas en la mayoría de los tumores renales de células claras, tanto de origen familiar como en gran parte de los casos esporádicos. Las evidencias que sustentan el uso de terapia anti–VEGF (factor de crecimiento del endotelio vascular) provienen de varias fuentes. En los años 90 se describió el papel de la proteína VHL (von Hippel–Lindau) en el control del factor inducible por hipoxia alfa (HIF) en condiciones de normoxia, además de la inducción de VEGF, TGF-alfa (factor de crecimiento transformante) y PDGF (factor de crecimiento derivado de plaquetas) por parte del HIF-alfa. Cuando hay una mutación, deleción o cualquier otro proceso de silenciamiento génico del gen de VHL (como ocurre en más del 70% de los casos de cáncer renal de células claras), se acumula HIF-alfa y, en consecuencia, se liberan factores proangiogénicos (VEGF), incluso en condiciones de normoxia, además de TGF-alfa y PDGF que estimulan el crecimiento de forma autocrina.
Antiangiogénicos e inmunoterapia
En base a este conocimiento se incorporó como pilar principal de tratamiento del cáncer renal avanzado el uso de antiangiogénicos. Durante los últimos años diferentes agentes con más o menos especificidad o afinidad sobre los distintos elementos de señalización de la vía de VEGF, con diferencias en cuanto a perfil de efectos secundarios, etc., han demostrado ser activos en las distintas fases de la evolución de la enfermedad.
Otra vía de control neoplásico frecuentemente desregulada en cáncer renal es aquella que ejerce nuestro sistema inmune sobre la generación y progresión de los tumores. La idea de modular nuestro sistema inmune para recuperar su correcta acción contra el cáncer renal es ya clásica, y de ahí que durante el final del siglo pasado y principios de este siglo XXI todavía se emplearan tratamientos con el Interferon-alfa o la Interleukina 2. El mejor conocimiento de la sinapsis inmunológica y la generación de los nuevos anticuerpos inhibidores de inmuno-check-point han permitido de nuevo reincorporar a la inmunoterapia como una estrategia protagonista en el tratamiento del cáncer renal.
Existen otras muchas vías de señalización celular, rutas metabólicas, mecanismos de control de ciclo celular, etc., que pueden verse alteradas en cáncer renal y también representan potenciales dianas cada vez mejor exploradas en pro de una auténtica personalización del tratamiento de nuestros pacientes. No obstante, su escasa frecuencia y la dificultad en la identificación de adecuados biomarcadores predictores de eficacia limitan su uso.
Secuenciación terapéutica
Lo habitual en nuestro medio es que los pacientes con carcinoma renal avanzado reciban, a lo largo de la evolución de su enfermedad, una secuencia de distintos tratamientos que logren, manteniendo una buena calidad de vida para el paciente, prolongar al máximo su supervivencia incluso hasta medianas superiores ya a los 40 meses.
En primera línea, la elección de tratamiento debe basarse en la disponibilidad de los tratamientos aprobados, el grupo pronóstico y las comorbilidades del paciente. De forma general, las combinaciones de inhibidores tirosina-quinasa (TKI) e inmunoterapia han demostrado beneficio en tasas de respuesta, supervivencia libre de progresión (SLP) y supervivencia global (SG) en comparación con TKI en monoterapia. Algunas de estas combinaciones incluyen pembrolizumab + axitinib, nivolumab + cabozantinib o pembrolizumab + lenvatinib. Sin embargo, existen algunos subgrupos de pacientes en los cuales se puede considerar el tratamiento con TKI como sunitinib, pazopanib o tivozanib en monoterapia, especialmente en aquellas situaciones en las que las combinaciones no están disponibles. Las combinaciones de inmunoterapia (ipilimumab + nivolumab) también han demostrado beneficio en supervivencia global en comparación con sunitinib en pacientes con pronóstico intermedio o pobre según la escala IMDC.
La segunda línea de tratamiento va a estar condicionada principalmente por la terapia recibida en primera línea. En aquellos pacientes que son tratados con un TKI anti-VEGF en monoterapia, las opciones recomendadas de tratamiento son la inmunoterapia (nivolumab) o cabozantinib (TKI dirigido frente a VEGF, MET y AXL). No obstante, debido a la creciente evolución en el empleo de combinaciones en primera línea, es necesaria mayor investigación en este escenario. Las guías clínicas recomiendan TKI que no hayan sido empleados en primera línea, entre las que se incluyen cabozantinib, axitinib, tivozanib, sunitinib, pazopanib o la combinación de lenvatinib-everolimus.
De forma reciente el estudio fase III LITESPARK-005 ha demostrado el beneficio de bezultifan (inhibidor oral de factor inducible por hipoxia HIF-2a) en supervivencia libre de progresión en pacientes previamente tratados con inmunoterapia y TKI.