Prevención
Índice de navegación
AUTORES:
Sección SEOM de Prevención y Diagnóstico Precoz
Cuando hablamos de prevención del cáncer, podemos referirnos fundamentalmente a dos aspectos. Uno de ellos es la prevención primaria, que consiste en reducir la incidencia de la enfermedad a través de evitar la exposición a determinados factores causales cuya presencia es necesaria o favorece la aparición de la enfermedad oncológica. Sin embargo, la prevención secundaria trata de detectar lo antes posible los tumores en personas sanas para que, a través de una intervención apropiada en esta fase precoz, se pueda modificar la historia natural de la enfermedad.
La Organización Mundial de la Salud (OMS) estima que entre un 30% y un 50% de los casos de cáncer son evitables. Para ello, es necesario reducir los factores de riesgo y aplicar estrategias preventivas de base científica.
|
|
|
|
|
|
|
|
|
4. Haga ejercicio a diario. Limite el tiempo que pasa sentado
|
|
5. Coma saludablemente:
|
|
6. Limite el consumo de alcohol, aunque lo mejor para la prevención del cáncer es evitar las bebidas alcohólicas
|
|
7. Evite una exposición excesiva al sol, sobre todo en niños. Utilice protección solar. No use cabinas de rayos UVA
|
|
8. En el trabajo, protéjase de las sustancias cancerígenas cumpliendo las instrucciones de la normativa de protección de la salud y seguridad laboral
|
|
9. Averigüe si está expuesto a la radiación procedente de altos niveles naturales de radón en su domicilio y tome medidas para reducirlos
|
|
10. Para las mujeres: |
|
11. Asegúrese de que sus hijos participen en los programas de vacunación para:
|
|
12. Participe en programas organizados de cribado del cáncer:
|
 Tabaco
Tabaco

El tabaco es el responsable del 30% de la mortalidad producida por cáncer, siendo su factor exógeno de riesgo más importante y la primera causa aislada de morbi-mortalidad evitable. En mayor o menor medida, se han relacionado con el tabaco los cánceres de pulmón, cavidad oral, laringe, faringe, esófago, estómago, hígado, páncreas, riñón, uréter, colon, recto, vejiga, cuello uterino, leucemias, hepatoblastoma y leucemia infantil.
El humo del tabaco lanzado al ambiente por los fumadores es dañino para las personas que lo inhalan (“fumadores pasivos”). Causa un pequeño incremento en el riesgo de cáncer de pulmón (se estima en 1%) y de enfermedades cardio-respiratorias, siendo particularmente perjudicial en niños pequeños que presentan un riesgo incrementado de afecciones respiratorias, cardiacas, otorrinolaringológicas, asma grave y muerte prematura y súbita del lactante.
Las políticas anti-tabaco deben plantearse a largo plazo, evitando el acceso al hábito, potenciando el abandono y dificultando la recaída. En la última década, se han establecido medidas de carácter normativo y legislativo, centradas en acuerdos sobre política fiscal con incremento de impuestos de tabaco, limitación de la publicidad -tanto directa como indirecta-, extensión de la prohibición de fumar en áreas públicas libres de humo, mejora de la información al consumidor (sobre los efectos, composición del tabaco) y actividades educativas y lúdicas alternativas con promoción de hábitos saludables (deporte…). Por otra parte, el consejo médico decidido y perseverante para dejar de fumar ha demostrado ser una de las medidas más útiles y eficientes para ganar años y calidad de vida en el conjunto de la población. La información continuada a la población constituye un valioso recurso para facilitar a los ciudadanos la adopción de decisiones saludables.
Alcohol

Para algunos cánceres, el efecto preventivo de una actividad física regular podría producirse independientemente de control del peso. Este es el caso del cáncer colorrectal, el cáncer de mama y el de endometrio, sea cual sea su peso corporal.
El efecto protector de la dieta podría mejorar con el aumento de los niveles de la actividad, aunque la recomendación es la de realizar ejercicio moderado, sobre todo en individuos con enfermedad cardiovascular.
Actividad física - Peso - Dieta
 Exposición solar
Exposición solar
La exposición excesiva al sol es más nociva durante la infancia y la adolescencia que durante la edad adulta. Algunos estudios han revelado que las quemaduras del sol que se producen antes de los quince años constituyen un factor de riesgo para el melanoma. Los solarios y lámparas ultravioleta tienen el mismo efecto dañino en la piel como la luz solar natural y se debe evitar en todo momento.
 Exposición ocupacional
Exposición ocupacional
 Radón
Radón

El radón es un gas radiactivo natural que se produce en la corteza terrestre. No puede ser detectado por los seres humanos, porque no tiene color ni olor, pero puede medirse debido a su radiactividad. Está presente sobre todo en las zonas con más uranio natural en el suelo y en las rocas. La exposición a radón aumenta el riesgo de cáncer de pulmón. Este riesgo es proporcional a la concentración de radón en el aire y la duración de la exposición. Además, es más probable que este riesgo aumente en personas fumadoras y exfumadoras. Existen mapas que se pueden utilizar para conocer si la zona de nuestra casa tiene mayor o menor riesgo de tener niveles altos de radón. Sin embargo, sólo una pequeña parte de los cánceres podrían estar producidos por radiación.
 Para las mujeres
Para las mujeres
Lactancia materna
Las mujeres que amamantan a sus bebés durante un periodo prolongado de tiempo tienen menor riesgo de cáncer de mama, comparado con las mujeres que no lactan. Cuanto más tiempo de lactancia, mayor protección contra el cáncer de mama. La reducción de riesgo es aproximadamente 4% por cada 12 meses acumulados de lactancia materna. Esto se suma a la reducción de riesgo conocida por tener un bebé. Por otra parte, la lactancia materna prolongada ayuda a la mujer a reducir la ganancia de peso a largo plazo, además promueve el retorno al peso anterior al embarazo.
Terapia hormonal sustitutiva
El uso de este tratamiento, aumenta el riesgo de algunos tipos de cáncer como son el cáncer de mama, el cáncer de endometrio y el cáncer de ovario. El patrón de riesgo de cáncer depende del tipo de terapia, es decir, de la composición hormonal de la misma (estrógenos sólo o en combinación con progestágenos). Los estudios han demostrado que el aumento de riesgo de cáncer de mama asociado a tratamiento hormonal de estrógenos y progesterona se produce después de unos años de tratamiento y se mantiene elevado durante al menos cinco años después de la discontinuación de la terapia, aunque el riesgo comienza a disminuir poco después de la retirada del mismo. Es por ello que este tratamiento se debe de tomar el mínimo tiempo posible y a la menor dosis, siempre bajo recomendación médica.
Vacunación
La infección causada por el virus de la hepatitis B es un problema de salud pública mundial, aproximadamente el 5% de la población está infectada crónicamente, causando la muerte de 600.000 personas cada año. Este virus causa daños en el hígado, y cuanto más tiempo dura la infección (hepatitis B crónica), más altas son las probabilidades de desarrollar cáncer de hígado.
La infección por VPH es la infección más frecuente de transmisión sexual. Aunque en la mayor parte de los casos es curada por el sistema inmunitario, en un pequeño porcentaje puede contribuir a desarrollar tumores, fundamentalmente el cáncer de cérvix, también de vulva y vagina en mujeres, el cáncer de canal anal y de garganta en hombres y mujeres, y cáncer de pene en los hombres.
Por otra parte, todavía hay algunos tipos de cáncer cuyas causas no son bien conocidas. Por este motivo, las medidas de prevención primaria han de completarse con actividades de diagnóstico precoz que deben implementarse con carácter poblacional y frente a procesos patológicos determinados. Los objetivos y las técnicas de prevención secundaria se resumen en las tablas 3 y 4.
|
|
|
1. Disminuir la prevalencia 2. Evitar las secuelas e invalideces 3. Mejorar el pronóstico 4. Disminuir las tasas de mortalidad
|
|
|
|
· Educación sanitaria de la población
· Estudios de detección selectiva • Detección selectiva clínica o Búsqueda de casos (case-finding) • Detección selectiva de la población o Cribado poblacional o screening
|
 Educación sanitaria y detección selectiva clínica
Educación sanitaria y detección selectiva clínica
 Cribado poblacional, detección selectiva de la población o screening
Cribado poblacional, detección selectiva de la población o screening
Para que una enfermedad pueda considerarse objeto de cribado debe cumplir una serie de requisitos propuestos por Wison en 1988 y que se resumen en la tabla 5.
|
|
|
En relación a la población En relación al programa En relación a la prueba |
b) Tumores sin justificación aún definida: próstata, pulmón, otros
c) Tumores en los que está justificado la realización de diagnóstico precoz en el contexto de un síndrome hereditario: mama y colon principalmente. Otros con menor evidencia: ovario, endometrio, próstata, gástrico, vías urinarias.
|
|
|
|
|
Población Intervención Evidencia |
|
Mama |
50-69 Mamografía / 2 años Demostrada 40-49 Mamografía / 1-2 años Insuficiente > 69 Mamografía / 2 años Insuficiente 30-70 Autoexploración/mes Insuficiente
|
|
Cérvix |
25-60 Papanicolau/1-3 años Demostrada
|
|
Colorrectal
|
50-74 SOH/Sigmoidos./1-2 años Demostrada Poliposis Rectosigmoidos/anual Efectivo S. Lynch Colonoscopia/2 años Demostrada Colitis Ulcerosa Colonoscopia/2 años Insuficiente
|
|
|
> 40 CA 125/ECO transvaginal Insuficiente > 25 y Ant. Fam. CA125/ECO/Examen Insuficiente |
|
Próstata |
> 50 PSA / anual Insuficiente ECO transrectal Insuficiente
|

 Papel de la prevención secundaria en relación con los diferentes tumores
Papel de la prevención secundaria en relación con los diferentes tumores
1. Cáncer de Mama
Si una mujer elige la autoexploración periódica, debería recibir instrucciones en cuanto la técnica, que sería revisada en los exámenes médicos rutinarios. Sería advertida de la necesidad de comunicar al médico la detección de cualquier nuevo síntoma; así mismo sería informada sobre los potenciales beneficios, limitaciones y perjuicios (principalmente la posibilidad de falsos positivos).
En mujeres de alto riesgo, tales como mujeres que han recibido radioterapia torácica para Enfermedad de Hodgkin, se recomienda el cribado con una mamografía y/o RM comenzando no más tarde de 7 años tras la finalización del tratamiento radioterápico. En caso de alto riesgo familiar o síndromes hereditarios, las recomendaciones se recogen en la tabla 8.
|
- La exploración clínica mamaria puede detectar casos palpables y ocultos por mamografía. Se recomienda repetirla cada 6 meses a partir de los 25 años. - Las exploraciones radiológicas mamarias: el gold estándar para la detección de cáncer de mama esporádico es la mamografía; sin embargo, en portadoras de mutaciones en los genes BRCA, el cáncer de mama aparece a edad más temprana, donde la mama es más densa y la mamografía pierde rendimiento. Por ello, debería individualizarse, en función de las características de la paciente, la realización de mamografía con ecografía complementaria o Resonancia Magnética de mama. Se recomienda iniciar el cribado a los 25 años o 10 años antes del caso más joven de la familia diagnosticado de cáncer de mama. - La mastectomía bilateral profiláctica, es una opción para disminuir el riesgo de cáncer de mama asociado a mutaciones en BRCA1 y BRCA2. Deben valorarse riesgos, beneficios y limitaciones. En mujeres con antecedente de cáncer de mama y portadora de mutación en BRCA, se recomienda la mastectomía bilateral, ya que ha demostrado beneficio en supervivencia. |
2. Cáncer Colorrectal
De este modo, la detección de una técnica que localice precozmente las lesiones premalignas y las erradique, lograría un descenso en la incidencia y mortalidad por esta entidad.
En base a la evidencia encontrada se puede argumentar que la estrategia mejor avalada para la realización de un cribado poblacional, sería la del test de sangre oculta en heces. Sin embargo, aunque es una prueba sencilla, barata y bien aceptada por la población, su sensibilidad es limitada (no supera el 50%) y el valor predictivo positivo es bajo (10-18% para el diagnóstico de cáncer y 21-38% para el diagnóstico de adenomas mayores de 10 mm).
Aunque la colonoscopia tiene mayor sensibilidad que el test fecal inmunológico, la tasa de detección de cáncer colorrectal, según el estudio COLONPREV, fue similar en los dos grupos; sin embargo, la participación en el estudio fue mayor en el grupo de la SOH y, la detección de adenomas mayor en el grupo de la colonoscopia.
Los principales inconvenientes de la colonoscopia, además del coste, son la morbilidad y la adherencia o participación; precisa una importante preparación del tubo digestivo y requiere sedación.
En resumen, el test de sangre oculta en heces (TSOH), integrado en un programa adecuado que permita descartar falsos positivos, puede llegar a reducir la mortalidad por cáncer colorrectal entre el 16% y el 27%. Se propone realizar la prueba cada dos años a partir de los 50 años.
Como método diagnóstico complementario al TSOH, la colonoscopia permite visualizar el colon a través de un tubo largo y flexible llamado endoscopio. Es por ello que el programa de detección precoz debe abordarse de manera integral de acuerdo con los criterios médicos apropiados.
Las opciones de screening pueden ser elegidas en base al riesgo individual, las preferencias personales y el acceso.
En moderado riesgo, se debería iniciar el screening a los 50 años con una de las siguientes pruebas:
- Sangre oculta en heces anual
- Detección del DNA exfoliado (se desconoce el intervalo óptimo)
- Colonoscopia cada 10 años
- Colonoscopia virtual/ colonografía cada 5 años
-Sangre oculta en heces anual con sigmoidoscopia cada 5 años
Con riesgo alto, considerado alto riesgo en alguna de las siguientes circunstancias:
- Historia de pólipos adenomatosos.
- Antecedentes personales de cáncer colorrectal.
- Antecedentes familiares de cáncer colorrectal en familiar de primer grado a una edad de diagnóstico joven.
- Alto riesgo por historia de enfermedad inflamatoria intestinal de larga evolución.
- Alto riesgo por sospecha o confirmación de síndrome hereditario (CCHNP).
En estos casos se recomienda la colonoscopia con mayor periodicidad y comenzando a una edad más joven.
Las recomendaciones específicas para los síndromes hereditarios de predisposición al cáncer de colon más frecuente, se describen en la tabla 9.
|
CÁNCER COLORRECTAL FAMILIAR SIN MUTACIÓN CONOCIDA: POLIPOSIS: |
3. Cáncer de cérvix
La historia natural de este tumor hace que sea un excelente candidato a un programa de cribado, dado que el 90% de las lesiones invasivas proviene de lesiones premalignas desarrolladas en un período no inferior a los 10 años. Sin embargo, el 1-2% de las lesiones premalignas dejadas a su evolución acabará en cáncer invasivo.
El objetivo es la detección de lesiones precursoras, permitiendo este diagnóstico temprano, aplicar tratamientos sencillos y obtener una curación completa.
Citología convencional
La citología del frotis vaginal (Papanicolau) ha demostrado su efectividad en el cribado del cáncer de cérvix reduciendo su mortalidad en un 60-90% y la incidencia de este tumor hasta en un 80% en países donde dicho cribado poblacional es organizado. En países con cribado oportunista, también ha mostrado un descenso, pero menos acentuado.
La citología convencional tiene bastantes falsos negativos, de ahí que se haya desarrollado la citología líquida.
Citología de fase líquida
Incrementa la sensibilidad, que conduce a una reducción del cáncer invasivo y obtención de muestras incorrectas. Además, permite disponer de material para el estudio de VPH.
Test del DNA del virus del papiloma humano
Es más sensible y menos específico que la citología, sobre todo, en mujeres jóvenes. La adición a la citología, en mujeres de alto riesgo, puede complementar la evaluación de citologías anormales y mejorar el seguimiento y cribado de mujeres con antecedentes de una lesión premaligna.
En Europa, se recomienda que las mujeres asintomáticas a partir de los 25 años, o las que sean o hayan sido sexualmente activas con edades comprendidas entre los 25-30 años deben iniciar el programa de cribado hasta la sexta década de la vida.
Tras el primer acceso, se realizarán 2 citologías con un intervalo de 1 año. Si resultan negativas, se recomienda la realización cada 3 años en edades comprendidas entre los 25-39 años, pudiéndose ampliar para mayores de 40 años a los 5 años.
A pesar de la incorporación de la vacuna frente al HPV como método de prevención primaria de cáncer de cérvix, el cribado citológico debe realizarse en igual medida. La vacuna protege frente a los subtipos de virus que con mayor frecuencia se relacionan con el cáncer; sin embargo, puede haber otros subtipos implicados frente a los que la vacuna no protege con capacidad de generar cáncer de cuello uterino.
4. Cáncer de piel
Al ser un tumor de localización preferentemente cutánea, es fácilmente accesible a la exploración aunque no existen datos suficientes, en la actualidad, que confirmen que el diagnóstico precoz reduzca la muerte de la enfermedad.
En Australia, donde la tasa de incidencia del melanoma es la más alta del mundo, se realizan programas de detección precoz en la población mediante el examen completo de la piel, que ha conseguido estabilizar el índice de mortalidad.
La vigilancia y la educación pública han permitido en Escocia el diagnóstico precoz del melanoma, de manera que la proporción de pacientes de buen pronóstico se ha elevado del 38 al 62% y los de mal pronóstico, han pasado del 34 al 15%.
Actualmente, en el ámbito europeo, no se dan recomendaciones para el screening del cáncer de piel.
5. Cáncer de Pulmón
En la actualidad, no se recomienda el screening de cáncer de pulmón en individuos asintomáticos.
Se ha empleado algún tipo de cribado en población seleccionada basada en radiografía de tórax, citología de esputo, TC y TC espiral con resultados discordantes y contradictorios sin reducción de la mortalidad global. La tomografía computarizada puede diagnosticar el cáncer de pulmón en sus estadios iniciales; sin embargo, la tasa de positivos falsos es alta relacionándose con un mayor uso de los procedimientos diagnósticos y terapéuticos.
No obstante, tradicionalmente, la Sociedad Americana ha reconocido que pacientes con alto riesgo de cáncer de pulmón, debido a la exposición al tabaco u ocupacional podrían decidir su deseo de someterse a un cribado tras consultarlo con el especialista.
Recientemente se ha puesto de manifiesto la utilidad del TC de baja dosis como prueba de diagnóstico precoz del cáncer de pulmón en personas de alto riesgo (exposición al tabaco); sin embargo, aún no esta claramente establecido cual debería ser el procedimiento y no existe recomendación formal para realizarlo.
6. Cáncer de próstata
En la actualidad, no existe recomendación formal para el cribado, aunque existe cierto entusiasmo por parte de los clínicos, traducido en un cribado oportunista.
Se han propuesto tres pruebas para el diagnóstico precoz: tacto rectal, determinación del antígeno prostático específico y ecografía transrectal. Ninguna ha demostrado reducción de la mortalidad y por tanto, no existe recomendación formal para el cribado.
Valores normales de PSA se pueden encontrar en, aproximadamente, un tercio de los hombres con cáncer de próstata localizado y sus niveles pueden estar aumentados en numerosas patologías no cancerosas como la hiperplasia benigna de próstata.
Por otro lado, la determinación poblacional de PSA, puede poner de manifiesto un cáncer de próstata incipiente, en varones asintomáticos, en los que este tumor nunca llegase a producir síntomas y la causa de la muerte fuera otra, dando lugar a un sobrediagnóstico (con la repercusión psicológica correspondiente) y a un sobretratamiento donde la tasa de efectos adversos (urinarios, sexuales, digestivos) es significativa.
Las guías de la Sociedad Americana de Cáncer enfatizan que la decisión compartida e informada sigue siendo la base del screening de cáncer de próstata. Se realizan las siguientes recomendaciones:
1. Varones asintomáticos con más de 10 años de esperanza de vida deben ser informados de riesgos y beneficios para tomar una decisión autónoma.
2. Varones con moderado riesgo deben ser informados no más tarde de los 50 años.
3. Varones con alto riesgo (varones afro-americanos; familiar de primer grado con cáncer de próstata y diagnóstico antes de los 65 años; mutaciones de BRCA1) deben ser informados a los 45 años. Tabla 10.
4. Varones con riesgo muy alto (múltiples miembros de la familia diagnosticados de cáncer de próstata antes de los 65 años) deben recibir esta información en torno a los 40 años.
5. Varones con incapacidad para decidir, la actitud puede ser tomada por el clínico.
6. A los varones asintomáticos con menos de 10 años de esperanza de vida (por edad o estado de salud) no se les debe ofrecer el screening.
Los varones que eligen ser testados:
1. Se recomienda screening con PSA +/- tacto rectal (el tacto rectal es recomendable en varones con hipogonadismo por la baja sensibilidad del PSA).
2. Varones, cuyo PSA es inferior a 2,5 ng/ml, pueden ser testados a intervalos bianuales; el screening habría de ser realizado anualmente en varones cuyo PSA esté entre 2,5 – 4 ng/ml.
3. PSA superior a 4 ng/ml requiere biopsia.
Existen otras guías cuyas recomendaciones son similares a las expuestas. Los intervalos de cribado y la necesidad o no de realizar tacto rectal, no están bien definidos.
Por todo lo expuesto, no existe una recomendación clara para realizar el cribado poblacional del cáncer de próstata.
Las recomendaciones referentes a personas de alto riesgo por portar mutaciones en los genes BRCA se exponen en la tabla 10.
|
|
7. Cáncer de ovario
|
La salpingo-oforectomía bilateral profiláctica, estaría indicada en estas pacientes, tras cumplir sus deseos genésicos, en torno a los 35-40 años. |
8. Cáncer de endometrio
1. Epidemiología y factores de riesgo del cáncer de mama
El cáncer de mama es un importante problema de salud pública debido a su alta incidencia, prevalencia y mortalidad. Se trata del tumor maligno más frecuente en mujeres a nivel mundial, con más de 1,67 millones de casos nuevos y más de medio millón de muertes por esta causa. Dentro de Europa existe un claro patrón geográfico, con mayor incidencia en Europa Occidental y del Norte y menor incidencia en Europa del Este, ocupando España una posición intermedia1. Se estima que en nuestro país en 2017 se diagnosticaron 26.370 casos nuevos y alrededor de 6.200 personas, casi todas mujeres, murieron por esta causa. De hecho, el cáncer de mama ocasiona la mayor mortalidad por cáncer en mujeres, seguido del cáncer colorrectal, pulmón y páncreas2.
En la últimas décadas los programas de detección precoz y los avances terapéuticos en el manejo de la enfermedad han logrado que la mortalidad por cáncer de mama descienda a un ritmo de un 1,8% anual, a pesar de que la incidencia continúa aumentando a un ritmo de un 1-2% anual. En la actualidad, la supervivencia del cáncer de mama a los 5 años del diagnóstico se eleva a un 80,3%, frente al 70% que presentaba en el periodo 85-892.
Existen distintos tipos de factores de riesgo, unos que se pueden controlar y otros que no. Factores de riesgo que no podemos controlar son el sexo, la edad, determinados factores genéticos y antecedentes familiares y personales. Pero hay otros factores que sí podemos controlar como el peso, la dieta, el ejercicio físico y el consumo de alcohol y de tabaco3.
1.1 La edad: es el principal factor de riesgo para el cáncer de mama. La incidencia de cáncer de mama aumenta a partir de los 45 a 50 años.
1.2 El género: el cáncer de mama es el tumor más frecuente en mujeres y ocurre hasta 100 veces más en las mujeres que en los hombres.
1.3 Factores familiares/hereditarios: las formas familiares comprenden casi el 20% de todos los tumores de mama, pero solo el 5-10% de los casos son hereditarios. Tener un familiar de primer grado con cáncer de mama duplica el riesgo mientras que mutaciones en determinados genes confieren un riesgo relativo 10-30 veces el de la población general. La presencia de mutaciones en genes de alta penetrancia como BRCA1, BRCA2, TP53, PTEN, CDH1 y otros que implican una alta probabilidad (>30-45%) de desarrollar este tumor, ocupan el primer lugar en cuanto a la magnitud de su efecto. Sin embargo, dada la rareza de estas mutaciones en población general, el riesgo atribuible a las mismas es relativamente bajo. Existen otros síndromes de moderado riesgo asociados a mutaciones en CHEK2, PALB2, ATM, que implican una probabilidad aumentada pero menor (20-30%) de desarrollar cáncer de mama.
1.4 Factores hormonales: Está claramente establecida la relación entre los niveles de estrógenos y el desarrollo de cáncer de mama. Así, son factores de riesgo la menarquia precoz (<12 años), la menopausia tardía, edad tardía del primer embarazo (>30 años) y la nuliparidad. Igualmente, el tratamiento hormonal sustitutivo conlleva un aumento del riesgo en las mujeres tratadas. Parece que la lactancia materna de larga duración (>12 meses) disminuye el riesgo de cáncer de mama. Por otro lado, el papel de los anticonceptivos orales, siguen siendo controvertido en relación al riesgo de cáncer de mama.
1.5 Factores dietéticos y estilo de vida: Las diferencias geográficas en la incidencia del cáncer de mama están en probable relación con la dieta, en concreto con la ingesta total de grasas. Se postula el papel protector de las frutas y verduras al disminuir la absorción de los estrógenos en el tubo digestivo, aunque estudios prospectivos no lo han confirmado. El sobrepeso es un factor de riesgo claro debido a que en mujeres menopáusicas la principal fuente de estrógenos es el tejido graso, además se ha establecido como factor de mal pronóstico. El ejercicio físico regular puede proteger a las mujeres premenopáusicas al alterar los ciclos ovulatorios y a las menopáusicas al prevenir la obesidad. La relación entre la ingesta de alcohol, el tabaco y las neoplasias de mama también ha sido establecida.
1.6 Factores ambientales y ocupacionales: Las radiaciones ionizantes, fundamentalmente en la infancia y la adolescencia, son factores de riesgo para el desarrollo de cáncer de mama. Las mujeres que recibieron irradiación del manto para el Linfoma Hodgkin antes de los 15 años tienen un riesgo significativamente mayor de cáncer de mama.
1.7 Lesiones premalignas: Las lesiones proliferativas con atipia, que incluyen la hiperplasia lobulillar y ductal, conllevan un aumento de riesgo de 4-5 veces. Otras lesiones mamarias proliferativas sin atipia incrementan el riesgo 1,5-2 veces. El carcinoma lobulillar in situ (CLIS) también se considera un marcador de alto riesgo (9-11 veces), mientras que el carcinoma ductal in situ (CDIS) podría considerarse una lesión premaligna invasiva.
1.8 Otros: Una mamografía con patrón denso es otro factor de riesgo.
Tabla 1. Factores de riesgo de cáncer de mama4
| RIESGO RELATIVO <2 | RIESGO RELATIVO 2-4 | RIESGO RELATIVO >4 |
|
|
|
La mujer promedio tiene entre un 10 y un 15% de probabilidades de desarrollar cáncer de mama si alcanza la edad de 90 años. La presencia de factores de riesgo ayuda a identificar a mujeres con mayor probabilidad de cáncer de mama que pueden beneficiarse de mayor vigilancia u otras medidas preventivas (quirúrgicas o farmacológicas). El hecho de tener uno o más factores de riesgo no quiere decir que se vaya a desarrollar un cáncer de mama y por el contrario, el no presentar ningún factor de riesgo no implica que no se pueda padecer la enfermedad.
2. Selección de mujeres candidatas a prevención farmacológica
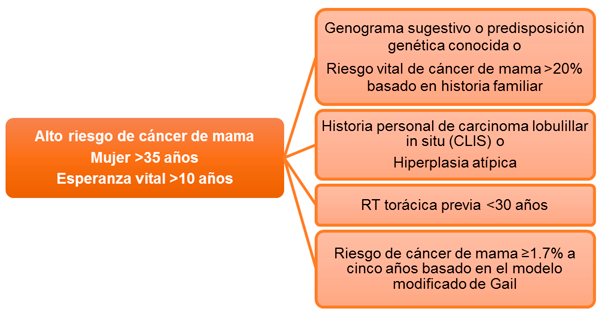
Debemos discutir los beneficios de la terapia endocrina en la prevención del cáncer de mama con mujeres con alto riesgo de este tumor según indican las guías National Comprehensive Cancer Network (NCCN)5, American Society of Clinical Oncology (ASCO)6, y United States Preventive Services Task Force (USPSTF)7. Los criterios de selección utilizados están basados en los ensayos de prevención e incluyen a mujeres con 35 años o más con una expectativa de vida de al menos 10 años y uno de los siguientes (Figura1):- Genograma sugestivo o predisposición genética conocida.
- Riesgo vital de cáncer de mama >20% basado en modelos que dependen de la historia familiar (BRCAPRO, BOADICEA).
- Historia personal de carcinoma lobulillar in situ (CLIS) o hiperplasia atípica.
- RT torácica previa antes de los 30 años de edad.
- Riesgo de cáncer de mama ≥1.7% a cinco años basado en el modelo modificado de Gail.
Guías americanas5, 7, 16
3. Prevención farmacológica con moduladores selectivos del receptor de estrógenos (SERM)
Tanto el tamoxifeno como el raloxifeno son opciones adecuadas para las mujeres con alto riesgo de cáncer de mama. En los ensayos de prevención el tratamiento en general se administró durante cinco años.
3.1 Tamoxifeno: a nivel de la glándula mamaria bloquea el efecto de los estrógenos, mientras que a nivel óseo o a nivel endometrial tiene un efecto agonista. Además de ser una opción de tratamiento para el cáncer de mama con receptores hormonales positivos, está aprobado en los Estados Unidos como quimioprevención en mujeres consideradas de alto riesgo. Los beneficios de los SERM en la prevención del cáncer de mama se resumen en el metaanálisis del USPSTF8 que incluye 7 ensayos randomizados con tamoxifeno y raloxifeno. Si nos centramos en los 4 ensayos que compararon el tamoxifeno frente a placebo, podemos concluir que el tamoxifeno:
- Reduce el riesgo de cáncer de mama (7 casos en 1000 mujeres en cinco años, RR 0.70; IC 95% 0.59-0.82), principalmente a costa de reducir el riesgo de cáncer de mama con receptores de estrógeno positivo.
- Disminuye de forma significativa la incidencia de fracturas no vertebrales (3 casos en 1000 mujeres, RR 0,66; IC 95% 0,45-0,98).
- No alcanza diferencias en mortalidad por cáncer de mama o por todas las causas.
Además de estos resultados, el seguimiento a largo plazo del Estudio Internacional de Intervención del Cáncer de Mama I (IBIS-1) mostró que el tamoxifeno produjo una reducción a largo plazo del riesgo de cáncer de mama con receptores hormonales positivos. En este estudio más de 7000 mujeres fueron asignadas aleatoriamente a cinco años de tamoxifeno o placebo. Con una mediana de seguimiento de 16 años9, el tamoxifeno redujo el riesgo de cáncer de mama infiltrante entre los 0 y 10 años (HR 0,72; IC 95% 0,59-0,88) y después de 10 años (HR 0,69; IC 95% 0.53-0.91). Como se había observado previamente, esta reducción del riesgo fue solo para el cáncer de mama con receptores hormonales positivos (HR 0,66; IC 95% 0,54-0,81), pero no para el cáncer de mama con receptores negativos (HR 1,05; IC 95% 0,71-1,57).
Si bien los beneficios del tamoxifeno están bien establecidos, el tratamiento también está asociado con efectos secundarios relevantes:
- Mayor incidencia de eventos tromboembólicos (4 casos en 1000 mujeres, RR 1.93; IC 95% 1.41- 2.64). Uno de los ensayo incluidos en el metaanálisis del USPSTF, el estudio P-1 del National Surgical Adjuvant Breast and Bowel Project (NSABP) mostró una tendencia hacia mayores tasas de ictus (1.75 versus 1.23 casos por 1000 mujeres, RR 1.42; IC 95% 0.97-2.08) y embolia pulmonar (0.69 versus 0.32 casos por cada 1000 mujeres, RR 2.15; IC 95% 1.08-4.51)10.
- Mayor incidencia de cáncer de endometrio (4 casos en 1000 mujeres, RR 2.13; IC 95% 1.36-3.32). En el estudio IBIS-1, el riesgo de cáncer de endometrio fue superior en los primeros cinco años de tratamiento (OR 3.76; IC 95% 1.20-15.56), pero no se observa mayor incidencia transcurridos los cinco años de tratamiento (OR 0.64; IC 95% CI 0.21-1,80)9.
Si bien los riesgos de tamoxifeno son mayores en comparación con el placebo, es importante señalar que la incidencia global de eventos adversos es pequeña.
3.2 Raloxifeno: de la misma familia que el tamoxifeno pero con efecto antagonista estrogénico sobre el endometrio. Además de su aprobación como agente para la prevención del cáncer de mama, está aprobado para el tratamiento de la osteoporosis en mujeres menopáusicas. Dentro del metaanálisis del USPSTF8, dos ensayos compararon el raloxifeno frente a placebo, y el raloxifeno ofrece:
- Una reducción en el riesgo de cáncer de mama infiltrante (0 casos en 1000 mujeres, RR 0,44; IC 95% 0,27-0,71). Al igual que con el tamoxifeno, el riesgo se redujo principalmente para el desarrollo de cáncer de mama con receptores de estrógenos positivos.
- Una reducción en la incidencia de fracturas vertebrales (7 casos en 1000 mujeres, RR 0,61; IC 95% 1,41-2,64).
- Sin aumento de la incidencia de cáncer de endometrio.
- Sin diferencias en la mortalidad por cáncer de mama o por todas las causas.
3.3 Elección de tamoxifeno versus raloxifeno:
- La administración de tamoxifeno o raloxifeno durante cinco años redujo la incidencia de cáncer de mama en 7 a 9 casos por cada 1000 mujeres. Uno de los ensayos incluidos en el metaanálisis del USPSTF, que comparó directamente el tamoxifeno con el raloxifeno (STAR P-2 trial), concluyó que el tamoxifeno fue un poco más eficaz en la prevención del cáncer de mama infiltrante (alrededor de un 24% superior al raloxifeno)11.
- El tratamiento con SERM no redujo significativamente el riesgo de cáncer de mama no invasivo o la mortalidad.
- En cuanto al perfil de toxicidad, tanto el tamoxifeno como el raloxifeno aumentan el riesgo de eventos tromboembólicos en comparación con el placebo (de 4 a 7 eventos por cada 1000 mujeres), el riesgo es mayor con el tamoxifeno. Además, el tamoxifeno provocó un mayor riesgo de cataratas y cáncer de endometrio (particularmente en mujeres mayores de 50 años).
- El raloxifeno sólo debe emplearse en mujeres menopáusicas
4. Prevención farmacológica con inhibidores de aromatasa (IA)
Los IA suprimen los niveles plasmáticos de estrógenos mediante la inhibición de la enzima aromatasa, que es responsable de la conversión periférica de andrógenos a estrógenos. Estos fármacos forman parte del tratamiento del cáncer de mama con receptores hormonales positivos en mujeres menopáusicas, de hecho demostraron una capacidad superior al tamoxifeno para prevenir la aparición de un segundo cáncer contralateral en mujeres tratadas de forma complementaria tras la cirugía. Dentro de los IA, solo anastrozol12 y exemestano13 han sido evaluados para prevención primaria y mostraron resultados similares.
4.1 Anastrozol: el International Intervention on Cancer Study (IBIS-II), incluyó aproximadamente 4000 mujeres menopáusicas con alto riesgo de cáncer de mama y las asignó al azar al tratamiento con anastrozol o placebo durante cinco años12. Los criterios de elegibilidad eran complejos y diferentes para cada grupo de edad, pero en general se definió como alto riesgo dos o más familiares de primer grado con cáncer de mama antes de los 50 años, o madre o hermana con cáncer de mama bilateral o historia personal de carcinoma lobulillar in situ (CLIS) o hiperplasia atípica. Tras una mediana de seguimiento de 5 años, se observó:
- Una reducción del 50% en el riesgo de cáncer de mama infiltrante en el brazo con anastrozol en comparación con placebo (32 [2%] versus 64 [3%], respectivamente, HR 0,47; IC del 95% 0,32-0,68). Además el anastrozol produjo una disminución similar en la incidencia de carcinoma ductal in situ (CDIS).
- De forma significativa más efectos secundarios musculo-esqueléticos (64 frente a 58%), hipertensión (5 versus 3%), sequedad vaginal (19 versus 16%) y síntomas vasomotores (57 frente a 49%).
4.2 Exemestano: su buen perfil de eficacia y tolerancia motivaron su elección para el estudio de quimioprevención MAP-3/ExCel13. En este ensayo se incluyeron 4.560 mujeres menopáusicas con alto riesgo para cáncer de mama, incluidas más de 400 mujeres españolas por medio del Grupo Español de Investigación del Cáncer de Mama (GEICAM). Se consideró alto riesgo a una puntuación superior a 1,67 en el test de Gail o antecedentes de lesiones mamarias de alto riesgo (hiperplasia ductal atípica, carcinoma lobulillar in situ o carcinoma intraductal tras mastectomía simple). Los resultados finales mostraron:
- Una reducción del 65% en la incidencia de cáncer de mama infiltrante en el brazo con exemestano en comparación con la rama placebo.
- Un perfil de toxicidad más favorable, los efectos secundarios fueron únicamente un 3% superiores en la rama de tratamiento activo. Incluso los trastornos musculoesqueléticos asociados a los IA fueron menores de lo esperado con escasa repercusión en la calidad de vida14.
En general, estos datos indican que los IA son una alternativa razonable a los SERM para las mujeres menopáusicas, aunque no se ha aprobado ninguno de estos fármacos para esta indicación.
5. Recomendaciones de las agencias
5.1 Las guías actualizadas en 2013 de la United States Preventive Services Task Force (USPSTF)15 apoyan la administración SERM (tamoxifeno o raloxifeno) para disminuir la incidencia de cáncer de mama infiltrante en mujeres de alto riesgo. El tamoxifeno fue más efectivo que el raloxifeno, pero también generó más cáncer de endometrio y cataratas. Ambos aumentan los eventos tromboembólicos.
5.2 La Sociedad Americana de Oncología Médica (ASCO)16 recomienda específicamente, en mujeres premenopáusicas tamoxifeno y en menopáusicas, tamoxifeno, raloxifeno o exemestano, siempre que se cumplan los criterios establecidos en los ensayos clínicos (riesgo a 5 años ≥1,66%, carcinoma lobulillar in situ o hiperplasia atípica) y siempre individualizando el consejo en función de los riesgos y beneficios de cada caso particular.
Debido a que los datos del ensayo International Intervention on Cancer Study (IBIS-II), se publicaron en 2014, ninguna de estas organizaciones incorpora el anastrozol como opción de tratamiento.
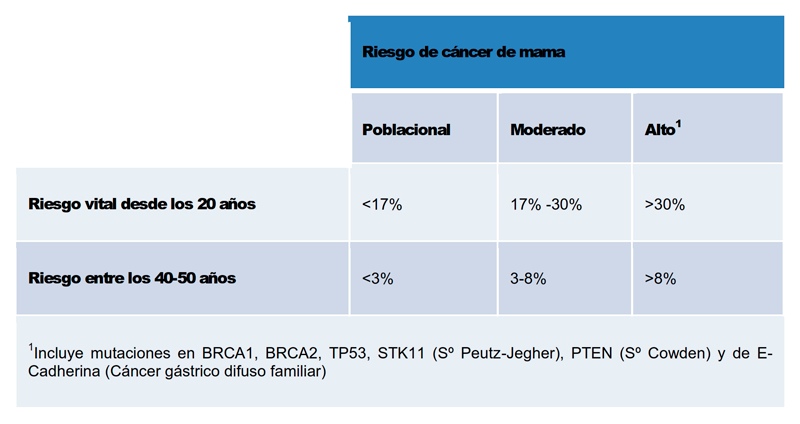
5.3 En 2017 se realiza la última enmienda de las guías del “National Institute for Health and Care Excellence británico” (NICE), donde se recomiendan tamoxifeno, raloxifeno y anastrozol como agentes con un coste-utilidad positivos para la prevención farmacológica del cáncer de mama, incluso aunque no han seguido el proceso formal de aprobación de esta indicación en dicho país17. Para esta agencia serán mujeres candidatas a quimioprevención aquellas con riesgo de cáncer de mama “moderado” (entre un 17 y un 30% para toda la vida o entre 3-8% en la década de los cuarenta) o “alto” (> 30% de riesgo vital total o > 8% en la década de los 40) (tabla 2). La elección del agente se basa en el perfil de efectos secundarios:
- Tamoxifeno para mujeres premenopáusicas, a menos que tengan un alto riesgo de enfermedad tromboembólica o cáncer de endometrio.
- Anastrozol en mujeres menopáusicas a menos que tengan osteoporosis severa.
- En mujeres menopáusicas con osteoporosis grave o que no desean tomar anastrozol, se ofrece tamoxifeno o si tienen mayor riesgo de cáncer de endometrio, se considera raloxifeno.
- No se recomienda mantener el tratamiento más allá de 5 años.
- No se recomienda prevención farmacológica en mujeres tras una mastectomía bilateral de reducción de riesgo.
![]()
- La adopción de un estilo de vida saludable, incluyendo la eliminación del tabaco, la reducción o eliminación del alcohol, la reducción alimentos ricos en grasas y en hidratos, el incremento de productos vegetales (verduras, frutas, cereales integrales) y la reducción/eliminación de tratamientos hormonales, es una estrategia eficaz en la prevención del cáncer de mama en la población general.
- En mujeres de alto riesgo, se recomienda valorar otras medidas preventivas incluyendo la mastectomía y ooforectomía profilácticas y la prevención farmacológica.
- En relación a la prevención farmacológica del cáncer de mama, tanto los SERM (tamoxifeno y raloxifeno) como los IA (exemestano y anastrozol) parecen ser opciones razonables, aunque solo el tamoxifeno y el raloxifeno han recibido aprobación de la FDA. Desconocemos si la quimioprevención con IA es más eficaz que un SERM, ya que no se han comparado directamente.
- Es importante comentar los riesgos y los beneficios de los tratamientos preventivos disponibles para que las mujeres con mayor riesgo puedan optar a su uso.
Bibliografía
1. Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase. No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer. doi:10.1016/j.ucl.2013.01.011.
2. Área de Epidemiología Ambiental y Cáncer. Mortalidad por cáncer en España.
https://www.isciii.es/QuienesSomos/CentrosPropios/CNE/EpidemiologiaCancerAmbiental/Paginas/default.aspx
3. DynaMed Plus [Internet]. Ipswich (MA): EBSCO Information Services. 1995 - . Record No. 901178, Risk factors for breast cancer; [updated 2018 Jun 01]; [about 24 screens]. Available from. http://www.dynamed.com/
4. Warner E. Breast-Cancer Screening. N Engl J Med. 2011;365(11):1025-1032. doi:10.1056/NEJMcp1101540
5. NCCN Guidelines for Detection, Prevention, & Risk Reduction: Breast Cancer Risk Reduction.
https://www.nccn.org/professionals/physician_gls/pdf/breast_risk.pdf (Accessed on August 30, 2018).
6. Visvanathan K, Chlebowski RT, Hurley P, et al. American society of clinical oncology clinical practice guideline update on the use of pharmacologic interventions including tamoxifen, raloxifene, and aromatase inhibition for breast cancer risk reduction. J Clin Oncol 2009; 27:3235.
7. Medications for Risk Reduction of Primary Breast Cancer in Women.
https://jamanetwork.com/journals/jama/fullarticle/2749220 (Accessed on August 30, 2018).
8. Nelson HD, Smith ME, Griffin JC, Fu R. Use of medications to reduce risk for primary breast cancer: a systematic review for the US Preventive Services Task Force. Annals of Internal Medicine 2013; 158(8): 604-614.
9. Cuzick J, Sestak I, Cawthorn S, et al. Tamoxifen for prevention of breast cancer: extended long-term follow-up of the IBIS-I breast cancer prevention trial. The Lancet Oncology. 2015;16(1):67-75. doi:10.1016/S1470-2045(14)71171-4.
10. Fisher B, Costantino JP, Wickerham DL, et al. Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer Inst 2005; 97:1652.
11. Vogel VG, Costantino JP, Wickerham DL, et al. Update of the National Surgical Adjuvant Breast and Bowel Project Study of Tamoxifen and Raloxifene (STAR) P-2 Trial: Preventing breast cancer. Cancer Prev Res (Phila) 2010; 3:696-706.
12. Cuzick J, Sestak I, Forbes JF, et al. Anastrozole for prevention of breast cancer in high-risk postmenopausal women (IBIS-II): an international, double-blind, randomised placebo-controlled trial. Lancet 2014; 383:1041-8.
13. Goss PE, Ingle JN, Alés-Martínez JE, et al. Exemestane for breast-cancer prevention in postmenopausal women. N Engl J Med 2011; 364:2381-91.
14. Maunsell E, Goss PE, Chlebowski RT, Ingle JN, Alés-Martínez JE, Sarto GE, et al. Quality of life in MAP.3 (Mammary Prevention 3): a randomized, placebo-controlled trial evaluating exemestane for prevention of breast cancer. J Clin Oncol. 2014 May 10;32(14):1427-36.
15. Heidi D. Nelson, MD, MPH; M.E. Beth Smith, DO; Jessica C. Griffin, MS; and Rongwei Fu, PhD. Use of Medications to Reduce Risk for Primary Breast Cancer: A Systematic Review for the U.S. Preventive Services Task Force. Ann Intern Med. 2013;158(8):604-614.
16. Visvanathan K, Hurley P, Bantug E, et al. Use of pharmacologic interventions for breast cancer risk reduction: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol 2013; 31:2942-62.
17. http://guidance.nice.org.uk/CG164





